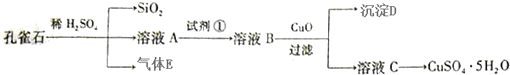
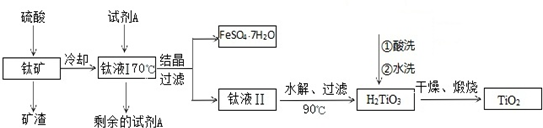
题目内容
10.减少污染、保护环境是全世界最热门的课题.Ⅰ.CO在催化剂作用下可以与H2反应生成甲醇:
①CO(g)+2H2(g)?CH3OH(g),△H1
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H-H | C-O | 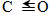 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
(2)图1中能正确反映反应①平衡常数的对数lgK随反应温度T的变化曲线为Ⅰ (填曲线标记字母),其判断理由是反应为放热反应,升高温度,平衡逆向移动,平衡常数数值及平衡常数的对数lgK随温度升高变小.
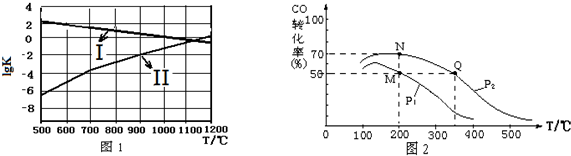
(3)在密闭容器中充有10mol CO与20mol H2,CO的平衡转化率与温度、压强的关系如图2.
①P1小于P2(填“大于”或“小于”),其判断理由是相同温度下,由于反应为气体分子数减小的反应,加压有利于平衡正移,提升CO的转化率,故P1<P2.
②M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为ν(M)<ν(N)<ν(Q).
③M、N、Q三点平衡常数KM、KN、KQ大小关系为KM=KN>KQ.
Ⅱ.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图3所示.已知:气体分压(P分)=气体总压(P总)×体积分数.
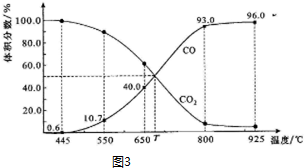
(1)完成下列填空:
①650℃时,反应达平衡后CO2的转化率为25.0%.
②T℃时,若充入等体积的CO2和CO,平衡不移动(填“向左移动”、“向右移动”或“不移动”)
③925℃时,P总=$\frac{1}{96}$MPa,用平衡分压代替平衡浓度表示的化学平衡常数KP=0.24 MPa.
分析 Ⅰ.(1)反应热=反应物总键能-生成物总键能;
(2)CO(g)+2H2(g)?CH3OH(g),△H1 =-299 kJ•mol-1,升温平衡逆向进行平衡常数减小,平衡常数的对数lgK减小;
(3)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大.
②p1小于p2,压强越大反应速率越大,则M点反应速率小于N点反应速率,Q点我的高于MN点,反应速率大;
③化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;
Ⅱ.(1)①由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
②由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{{P}^{2}(CO)}{P(C{O}_{2})}$来回答
解答 解:Ⅰ.(1)CO(g)+2H2(g)?CH3OH(g),反应热=反应物总键能-生成物总键能=876+2×436-(3×413+343+465)=-299 kJ•mol-1,
故答案为:-299 kJ•mol-1;
(2)CO(g)+2H2(g)?CH3OH(g),△H1 =-299 kJ•mol-1,升温平衡逆向进行平衡常数减小,平衡常数的对数lgK减小,图象中符合的是Ⅰ,
故答案为:I,反应为放热反应,升高温度,平衡逆向移动,平衡常数数值及平衡常数的对数lgK随温度升高变小;
(3)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,
故答案为:小于;相同温度下,由于反应为气体分子数减小的反应,加压有利于平衡正移,提升CO的转化率,故P1<P2;
②p1小于p2,压强越大反应速率越大,则M点反应速率小于N点反应速率,Q点我的高于MN点,反应速率大,则M、N、Q三点平均速率ν(M)、ν(N)、ν(Q)大小关系为ν(M)<ν(N)<ν(Q),
故答案为:ν(M)<ν(N)<ν(Q);
③化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ,
故答案为:KM=KN>KQ;
Ⅱ(1)①由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为$\frac{0.25}{1}$×100%=25%,故答案为:25%;
故答案为:25.0%;
②由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,T℃时,若充入等体积的CO2和CO平衡不移动,
故答案为:不移动;
③925℃时,P总=$\frac{1}{96}$MPa,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{{P}^{2}(CO)}{P(C{O}_{2})}$=$\frac{({P}_{总}×96%)^{2}}{{P}_{总}×4%}$=0.24 MPa,故答案为:0.24 MPa;
点评 本题考查了化学平衡图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 解释化学反应速率理论有碰撞理论和过渡态理论,其中过渡态理论可解释温度、催化剂等因素对化学反应速率的影响 | |
| C. | 离子交换膜在工业上应用广泛,如氯碱工业使用阳离子交换膜 | |
| D. | 用氨水法处理燃煤烟气中的二氧化硫,既可消除其污染,又可得到副产品硫酸铵 |
| A. | 3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
①
 ②乙烯③SO2 ④氯乙烯
②乙烯③SO2 ④氯乙烯⑤CH2═CH-COOH ⑥苯 ⑦聚乙烯.
| A. | ①⑥⑦ | B. | ①③④⑥ | C. | ①④⑦ | D. | ①③⑥⑦ |
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品. 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.