题目内容
16.某200mL氯化镁和氯化铝混合液中c(Mg2+)为0.3mol/L,c(Cl-)为1.2mol/L.要使Mg2+全部转化为沉淀分离出来,至少需加4mol/L NaOH溶液的体积为( )| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |
分析 根据电荷守恒可知:2n(Mg2+)+3n(Al3+)=n(Cl-),据此计算n(Al3+).欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(NaCl)+(NaAlO2)=n(Cl-)+n(Al3+),进而计算需要氢氧化钠溶液体积.
解答 解:溶液中存在2n(Mg2+)+3n(Al3+)=n(Cl-)=0.2L×1.2mol/L=0.24mol,
因n(Mg2+)=0.3mol/L×0.2L=0.06mol,可知n(Al3+)=$\frac{1}{3}$×(0.24mol-0.06mol×2)=0.04mol,
欲使Mg2+全部沉淀分离出来,可发生Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,利用Na、Cl、Al原子守恒,有n(NaOH)=n(NaCl)+(NaAlO2)=n(Cl-)+n(Al3+)=0.24mol+0.04mol=0.28mol,
则至少需要加入4mol/L NaOH溶液的体积为$\frac{0.28mol}{4mol/L}$=0.07L=70mL,
故选A.
点评 本题考查混合物的计算,为高频考点,把握Mg2+全部转化为沉淀分离出来时发生的反应、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.提纯下列物质除去其中的杂质(括号中为杂质),所用试剂和方法一定正确的是( )
| A. | H2SO4(HCl):AgNO3溶液、过滤 | B. | KNO3(K2SO4):Ba(NO3)2溶液、过滤 | ||
| C. | Cu(CuO):盐酸、过滤 | D. | CaCO3(CaO):加一些水、过滤 |
7.下列说法正确的是( )
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是1:2 |
4.同温下,向甲(保持恒容)乙(保持恒压)两个容器中分别加入物质的量均为1mol的A与发生可逆反应A(g)+B(g)?C(g),起始时两容器的体积相等,达到平衡状态后,下列说法正确的是( )
| A. | 容器甲中分子总数多 | B. | 容器甲中C的浓度大 | ||
| C. | 容器甲中反应速率快 | D. | 容器甲中转化率大 |
11.用已知浓度的酸滴定未知浓度的碱时,用甲基橙作指示剂,会导致待测碱液的浓度偏低的操作是( )
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③锥形瓶用蒸馏水洗后,用待测夜润洗
④滴定前酸式滴定管尖嘴部分有气泡,滴定完成后气泡消失
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③锥形瓶用蒸馏水洗后,用待测夜润洗
④滴定前酸式滴定管尖嘴部分有气泡,滴定完成后气泡消失
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
| A. | ①③④ | B. | ②⑤ | C. | ②③⑤ | D. | ②④ |
8.下列电子式书写正确的是( )
| A. | 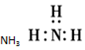 | B. | 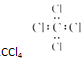 | C. | 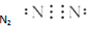 | D. | 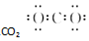 |
5.下列有机坊与其名称相符的是( )
| A. |  :2-甲基丙烯 :2-甲基丙烯 | B. | (CH3)2CHCH(CH3)2:1,4-而甲基丁烷 | ||
| C. | 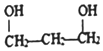 :1,3-二丙醇 :1,3-二丙醇 | D. | 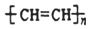 :聚乙烯 :聚乙烯 |
6.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):H2(g)+Cl2(g)-→2HCl(g)+Q1H2(g)+Br2(g)-→2HBr(g)+Q2有关上述反应的叙述正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1 mol HCl气体时放出Q1 kJ热量 | |
| D. | 1 mol HBr(g)具有的能量小于1 mol HBr(l)具有的能量 |