题目内容
18.某抗酸药每片含有碳酸钙534mg,氢氧化镁180mg.(1)抗酸药片中还可能含有什么物质?淀粉、糖.
(2)写出该抗酸药发挥功效时的化学方程式(任写一个)CaCO3+2HCl═CaCl2+CO2↑+H2O、Mg(OH)2+2HCl═MgCl2+2H2O.
分析 (1)抗酸药除了含有抑酸剂外,还含有一些调味剂、黏合剂等辅料;
(2)抗酸药能和胃酸中的盐酸发生复分解反应,以此写出化学方程式.
解答 解:(1)抗酸药片中除了能与盐酸作用的有效成分外,还可能含有调味剂如糖、黏合剂如淀粉等,故答案为:淀粉;糖;
(2)碳酸钙和盐酸反应的化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O,氢氧化镁和盐酸反应的化学方程式:Mg(OH)2+2HCl═MgCl2+2H2O,
故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O;Mg(OH)2+2HCl═MgCl2+2H2O.
点评 本题考查本题考查药物的成分和疗效,题目难度不大,注意理解反应的原理.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.(1)根据最新“人工固氮”的研究报道,在常温、光照条件下,N2在催化剂(掺有少最Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(g)?2NH3(g)+$\frac{3}{2}$O2(g)△H=aJ/mol,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此合成反应的a>0;△s>0(填“>”、“<”或“=”)
(2)己知:常温下,0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”).
H2A的电离方程式为H2A H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}=1{0}^{10}$.0.010.1mol/L的BOH溶液pH=12,请回答下列问题:
①HA是弱电解质(填”强电解质”或“弱电解质”,下同).
②在加水稀释HA的过程中,随着水量的增加而减小的是B(填字母).
A.$\frac{c({H}^{+})}{c(HA)}$ B.$\frac{c(HA)}{c({A}^{-})}$ C.(H+)与c(OH-)的乘积 D.c(OH-)
③在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体多(填“多”“少”或“相等”).
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(2)己知:常温下,0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”).
H2A的电离方程式为H2A
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}=1{0}^{10}$.0.010.1mol/L的BOH溶液pH=12,请回答下列问题:
①HA是弱电解质(填”强电解质”或“弱电解质”,下同).
②在加水稀释HA的过程中,随着水量的增加而减小的是B(填字母).
A.$\frac{c({H}^{+})}{c(HA)}$ B.$\frac{c(HA)}{c({A}^{-})}$ C.(H+)与c(OH-)的乘积 D.c(OH-)
③在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体多(填“多”“少”或“相等”).
14.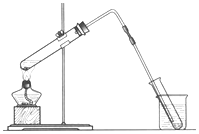 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
③为确保杂质除尽,所加试剂应适当过量.如何判断SO42-是否除尽?静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
9.能实现下列物质间直接转化的元素是( )
单质$\stackrel{O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
单质$\stackrel{O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 硅 | B. | 硫 | C. | 铝 | D. | 铁 |
5.下列有关化学用语的表述正确的是( )
| A. | 次氯酸的电子式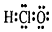 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: