题目内容
8.在下列溶液中分别放入铁棒,过一会儿把铁棒取出,(1)能使铁棒质量增加的溶液是____;(2)溶液质量增加的是______.( )| A. | 稀硫酸 | B. | 食盐水 | C. | 硫酸铜溶液 | D. | 乙醇水溶液 |
分析 利用差量法,把溶液作为一个整体,分析影响溶液质量的量有哪些,再根据金属活动性顺序及各物质发生化学反应时的质量关系来分析解答.在金属活动性顺序表中,氢前面的金属能和常见的酸发生置换反应,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来.
解答 解:A、把铁片放入稀硫酸溶液中,铁能和稀硫酸反应,生成可溶于水的硫酸亚铁和氢气,进入溶液中的发生反应的铁的质量要比逸出的氢气的质量要大得多,因此溶液的质量会增加,铁棒质量减小;
B、铁放入食盐水,铁和氯化钠、水不反应,溶液的质量不变,铁棒质量不变,故B错误;
C、铁与硫酸铜反应生产硫酸亚铁和铜,
Fe+CuSO4═FeSO4+Cu
56 64
参加反应的铁的质量小于生成的铜的质量,所以溶液质量减小,铁棒表面析出铜,质量增加;
D、铁放入乙醇水溶液不发生反应,铁棒质量不变,溶液质量不变,
(1)能使铁棒质量增加的溶液是C,故选:C;
(2)溶液质量增加的是A,故选:A.
点评 本题考查了金属与酸或盐反应时溶液质量的变化,完成此题,可以依据物质间反应的化学方程式进行计算,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
3.根据有机化合物的命名原则,下列命名正确的是( )
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 3-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
4.某一元弱酸溶液的c(H+)=0.1mol/L,该酸溶液的物质的量浓度为( )
| A. | 等于0.1mol/L | B. | 大于0.1mol/L | C. | 小于0.1mol/L | D. | 无法判断 |
3.下列指定反应的离子方程式正确的是( )
| A. | 将铜插入浓硝酸中:Cu+4H++2NO3?═Cu2++2NO2↑+2H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++Cl2═2Fe3++2Cl? | |
| C. | 向Al2O3中加入氨水:Al2O3+2OH?═2AlO2?+H2O | |
| D. | 碳和浓硫酸加热:C+2H++SO42?═H2O+SO2↑+CO2↑ |
13.甲、乙两种物质的溶解曲线如图所示.下列说法正确的是( )
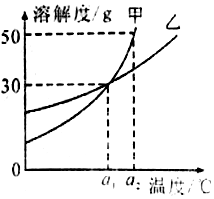

| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
20.Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al | |
| D. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |