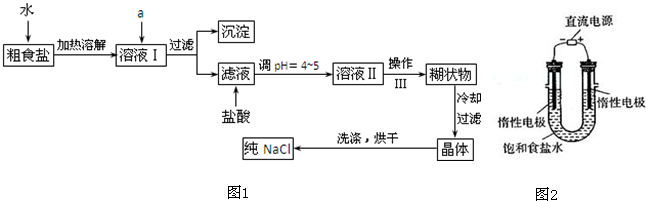
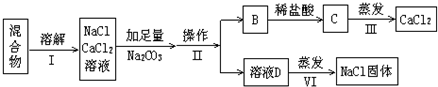
题目内容
我国规定饮用水质量标准必须符合下列要求:
如图是源水处理成自来水的工艺流程示意图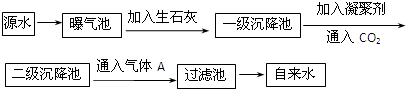
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式 ;
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号);
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4?7H2O是常用的凝聚剂,它在水中最终生成 沉淀;
(3)气体A的作用是 ,这种作用是基于气体A和水反应的产物具有 性;
(4)下列物质中, 可以作为气体A的代用品(填写编号).
①Ca(ClO)2 ②浓氨水 ③K2FeO4 ④SO2.
| PH | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol?L-1 |
| 细菌总数 | <100个?mL-1 |

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式
(2)凝聚剂除去悬浮固体颗粒的过程
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4?7H2O是常用的凝聚剂,它在水中最终生成
(3)气体A的作用是
(4)下列物质中,
①Ca(ClO)2 ②浓氨水 ③K2FeO4 ④SO2.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)氢氧化钙中的氢氧根离子可以和镁离子,碳酸氢根离子反应;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀易被氧化为氢氧化铁;
(3)氯气与水反应生成盐酸和次氯酸,HClO具有强氧化性,能杀菌消毒;
(4)氯气具有强氧化性,能杀菌消毒,则作为Cl2的替代品的物质需具有强氧化性.
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀易被氧化为氢氧化铁;
(3)氯气与水反应生成盐酸和次氯酸,HClO具有强氧化性,能杀菌消毒;
(4)氯气具有强氧化性,能杀菌消毒,则作为Cl2的替代品的物质需具有强氧化性.
解答:
解:(1)氢氧化钙中的氢氧根离子可以和镁离子,碳酸氢根离子反应,碳酸根离子还可以和钙离子反应,即HCO3-+OH -=CO32-+H2O;Mg2++2OH-=Mg(OH)2↓Ca2++HCO3-+OH-=CaCO3↓+H2O,故答案为:Mg2++2OH-=Mg(OH)2↓(或HCO3-+OH -=CO32-+H2O或Ca2++HCO3-+OH-=CaCO3↓+H2O);
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀,则既发生物理变化又发生化学变化,且亚铁离子与碱反应生成沉淀易被氧化为红褐色沉淀Fe(OH)3,故答案为:③;Fe(OH)3;
(3)氯气与水反应生成盐酸和次氯酸,该反应为Cl2+H2O═HCl+HClO,HClO具有强氧化性,能杀菌消毒,故答案为:杀菌、消毒;强氧化;
(4)氯气具有强氧化性,能杀菌消毒,则作为Cl2的替代品的物质需具有强氧化性,选项中只有①③具有强氧化性,故答案为:①③.
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀,则既发生物理变化又发生化学变化,且亚铁离子与碱反应生成沉淀易被氧化为红褐色沉淀Fe(OH)3,故答案为:③;Fe(OH)3;
(3)氯气与水反应生成盐酸和次氯酸,该反应为Cl2+H2O═HCl+HClO,HClO具有强氧化性,能杀菌消毒,故答案为:杀菌、消毒;强氧化;
(4)氯气具有强氧化性,能杀菌消毒,则作为Cl2的替代品的物质需具有强氧化性,选项中只有①③具有强氧化性,故答案为:①③.
点评:本题考查自来水的净化及离子之间的反应,明确净化原理及各物质的性质、发生的化学反应是解答本题的关键,(2)为解答的难点,题目难度中等.

练习册系列答案
相关题目
下列有机物分子中,所有的原子不可能在同一平面上的是( )
| A、CH2=CH-C≡N |
| B、CH2=CF-CF=CH2 |
C、 |
D、 |
一定量某营养液中溶质的配方分别如下:对于两种营养液的成分,下列说法中正确的是( )
配方一:0.2mol KCl,0.1mol K2SO4,0.3molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
配方一:0.2mol KCl,0.1mol K2SO4,0.3molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
| A、只有n (K+)相同 |
| B、只有n (Cl-)相同 |
| C、各离子的物质的量完全相同 |
| D、各离子的物质的量完全不同 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为NA |
| B、500mL1moL/L的盐酸溶液中含有的HCl分子数为0.5NA |
| C、将1L2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D、23gNa与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA |
 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO