题目内容
一定量某营养液中溶质的配方分别如下:对于两种营养液的成分,下列说法中正确的是( )
配方一:0.2mol KCl,0.1mol K2SO4,0.3molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
配方一:0.2mol KCl,0.1mol K2SO4,0.3molZnSO4
配方二:0.1mol KCl,0.3mol K2SO4,0.1molZnCl2.
| A、只有n (K+)相同 |
| B、只有n (Cl-)相同 |
| C、各离子的物质的量完全相同 |
| D、各离子的物质的量完全不同 |
考点:溶液的配制,物质的量浓度
专题:物质的量浓度和溶解度专题
分析:信息中的溶质都是强电解质,溶于水全部电离出自由移动的离子,根据两份营养液的溶质的物质的量,计算出溶质电离出的各离子的物质的量,据此解答.
解答:
解:溶质均为强电解质,溶于水全部电离出自由移动的离子,两份溶液中含有的离子相同,离子是:K+ Cl- SO42- Zn2+,分别计算两溶液中各离子的物质的量.
第一份:n(K+ )=0.2mol+2×0.1 mol=0.4mol,
n(Cl- )=0.2mol,
n( SO42- )=0.1mol+0.3mol=0.4mol,
n( Zn2+)=0.3mol,
第二份:n(K+ )=0.1mol+2×0.3mol=0.7mol,
n(Cl- )=0.1mol+2×0.1mol=0.3mol,
n(SO42- )=0.3mol,
n( Zn2+)=0.1mol,
则离子的物质的量完全不同,
故选D.
第一份:n(K+ )=0.2mol+2×0.1 mol=0.4mol,
n(Cl- )=0.2mol,
n( SO42- )=0.1mol+0.3mol=0.4mol,
n( Zn2+)=0.3mol,
第二份:n(K+ )=0.1mol+2×0.3mol=0.7mol,
n(Cl- )=0.1mol+2×0.1mol=0.3mol,
n(SO42- )=0.3mol,
n( Zn2+)=0.1mol,
则离子的物质的量完全不同,
故选D.
点评:本题考查电解质的电离、物质的量的计算,学生应熟悉利用电离来分别计算各离子的物质的量,然后再判断选项是否正确,难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水.
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水.
| A、①② | B、②③ | C、①④ | D、④⑤ |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )、


| A、溶液上层无色,下层紫红色 |
| B、装置②可用于吸收HCl气体,并防止倒吸 |
| C、装置③可用于制取蒸馏水 |
| D、装置④b口进气可收集H2、CO2等气体 |
可逆反应mA(固)+nB(气)?Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
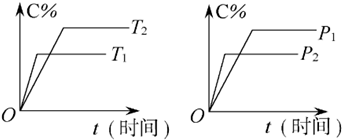

| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
 和1个-OH.则B可能结构有4种,已知其中2种结构简式为
和1个-OH.则B可能结构有4种,已知其中2种结构简式为 、
、 ,请写出另外两种
,请写出另外两种