题目内容
16.已知热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
据此判断下列说法正确的是( )
| A. | CH3OH的燃烧热为1452kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ•mol-1 | |
| C. | 2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-880.4kJ•mol-1 | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H=-57.3kJ•mol-1 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.液态水变化为气态水需要吸收热量,放热焓变为负值比较大小;
C.依据热化学方程式和盖斯定律计算判断;
D.醋酸是弱酸存在电离平衡,电离过程是吸热过程.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1,反应焓变是2mol甲醇弱酸生成稳定氧化物放出的热量,不是燃烧热,故A错误;
B.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,液态水变化为气态水需要吸收热量,放热焓变为负值比较大小,2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ•mol-1 ,故B正确;
C.依据热化学方程式和盖斯定律计算判断,①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1 ,依据盖斯定律计算②-①×2得到2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-308.8kJ•mol-1,故C错误;
D.醋酸是弱酸存在电离平衡,电离过程是吸热过程,焓变为负值,CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H>-57.3kJ•mol-1,故D错误;
故选B.
点评 本题考查了化学反应的能量变化和焓变比较大小,注意燃烧热、中和热概念的理解应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |
4.(1)在钠碱循环法吸收尾气中的SO2时,Na2SO3溶液作为吸收液.写出吸收时发生的有关离子方程式:SO32-+SO2+H2O=2HSO3-
(2)吸收液吸收SO2的过程中,pH随n (SO32-):n(HSO3-)变化关系如下表:
①表判断Na HSO₃溶液显酸性,其本质原因是:HSO3-电离大于其水解
②吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(2)吸收液吸收SO2的过程中,pH随n (SO32-):n(HSO3-)变化关系如下表:
| n(SO₃2-):,n(HSO₃-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
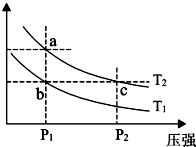 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.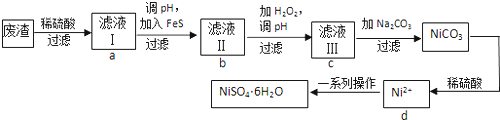
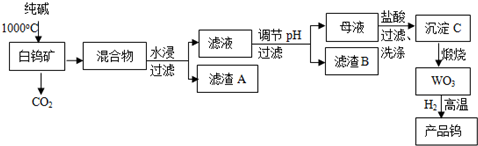

 .
.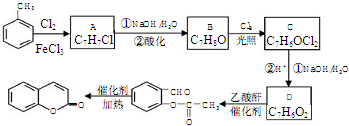
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应. )反应,除生成
)反应,除生成 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH. 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点: ;写出A分子中官能团的名称羟基、羧基;
;写出A分子中官能团的名称羟基、羧基; ;
;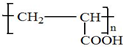 .
.
 .
.