题目内容
5.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:①称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍
②将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g.
③另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况).
④核磁共振氢谱显示A分子中有4种不同环境的氢原子,且4种氢原子个数比为3:1:1:1.
根据以上实验结果,回答下列问题.
(1)A的分子结构简式为
 ;写出A分子中官能团的名称羟基、羧基;
;写出A分子中官能团的名称羟基、羧基;(2)A的系统命名是2-羟基丙酸;
(3)A可在浓硫酸催化下生成一种六元环酯,写出该反应的化学方程式
 ;
;(4)A的一种同分异构体B与A具有相同的官能团,B分子经过如下两步反应可得到一种高分子化合物D,B$→_{-H_{2}O}^{消去反应}$C$\stackrel{加聚反应}{→}$D,写出D的结构简式
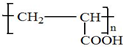 .
.
分析 有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为45×2=90,浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量是$\frac{5.4g}{18g/mol}$=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是$\frac{13.2g}{44g/mol}$=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,生成2.24LCO2(标准状况),则含有一个羧基,醇羟基可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),则含有羟基数目是1个,根据核磁共振氢谱图看出有机物中有4个峰值,则含,4种类型的等效氢原子,氢原子的个数比是3:1:1:1,所以结构简式为: ,然后结合有机物的结构与性质来解答.
,然后结合有机物的结构与性质来解答.
解答 解:有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为45×2=90,浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量是$\frac{5.4g}{18g/mol}$=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是$\frac{13.2g}{44g/mol}$=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,生成2.24LCO2(标准状况),则含有一个羧基,醇羟基可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),则含有羟基数目是1个,根据核磁共振氢谱图看出有机物中有4个峰值,则含,4种类型的等效氢原子,氢原子的个数比是3:1:1:1,所以结构简式为: ,
,
(1)由上述分析可知,A的结构简式为 ,官能团为羟基、羧基,故答案为:
,官能团为羟基、羧基,故答案为: ;羟基、羧基;
;羟基、羧基;
(2)A的系统命名是2-羟基丙酸,故答案为:2-羟基丙酸;
(3)A可在浓硫酸催化下生成一种六元环酯,该反应的化学方程式为 ,
,
故答案为: ;
;
(4)B分子经过如下两步反应可得到一种高分子化合物D,B$→_{-H_{2}O}^{消去反应}$C$\stackrel{加聚反应}{→}$D,则B发生消去反应生成C为CH2=CHCOOH,C发生加聚反应生成D为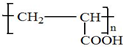 ,故答案为:
,故答案为: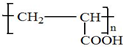 .
.
点评 本题考查有机物的推断及结构与性质,为高频考点,把握有机物分子式的确定方法、结构中的官能团与性质为解答的关键,侧重分析与推断能力的考查,题目难度不大.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案| A. | 氯气 | B. | 氨气 | C. | 氯化钠 | D. | 氧化镁 |
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
据此判断下列说法正确的是( )
| A. | CH3OH的燃烧热为1452kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H>-571.6kJ•mol-1 | |
| C. | 2CH3OH(l)+O2(g)═2CO2(g)+4H2(g)△H=-880.4kJ•mol-1 | |
| D. | CH3COOH(aq)+NaOH(aq)═H2O(l)+CH3COONa(aq)△H=-57.3kJ•mol-1 |
| 操作过程 | 实验现象 |
| 将干燥纯净的CO2缓缓通过放有钠的已排尽空气的干燥玻璃管中,加热 | 钠燃烧,火焰为黄色 |
| 反应后冷却 | 管壁附有黑色颗粒和白色物质 |
Ⅰ.白色物质可能是Na2O;
Ⅱ.白色物质可能是Na2CO3
Ⅲ.白色物质还可能是Na2O和Na2CO3混合物
(2)为确定该白色物质的成分,该小组进行了如下实验:
| 实验步骤 | 实验现象 |
| ①少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加过量的CaC12溶液出现白色沉淀 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②则钠在CO2中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
③丙同学认为白色物质有可能是氢氧化钠,你认为是否合理并说出理由不正确,因为反应物中无H元素(或违背质量守恒定律).
(3)丁同学称取Na2O样品mg(假设只含有Na2O2杂质),请你与他合作从下面选用合适的仪器和试剂,设计一种可选用的实验仪器组合,填写下表以完成样品中Na2O含量的测定.可选用的试剂:

a.浓硫酸 b.水 c.盐酸标准溶液 d.NaOH 标准溶液 e.酚酞 f.碱石灰 g.稀盐酸
| 实验过程中发生反应的化学方程式 | 实验所需仪器(用字母表示) | 实验所需试剂(用字表示) | 实验需直接测定的有关物理量(用文字说明) |
7.75gNa2O样品$\stackrel{在氧气中充分灼烧}{→}$固体$\stackrel{冷却}{→}$称量得固体9.35g.该Na2O产品中Na2O的质量分数为80%.
| A. | a>b>c | B. | b>a>c | C. | c>b>a | D. | b>c>a |
称取一定质量的KCl、NaClO4,溶解后混合,经冷却、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到,有关物质溶解度与温度的关系如下表:
| 温度 溶解度 化学式 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
(2)热电池是以熔盐作电解质,利用热源使其溶化而激活得一次储备电池.Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为FeS2+4Li═Fe+2Li2S.
(3)Fe和KClO4反应放出的热量能为熔融盐电池提供550-660℃的温度,使低熔点盐熔化导电,从而激活电池,其供热原理为:KClO4 (s)+4Fe(s)═KCl (s)+4FeO(s),△H<0.
①600℃时FeO可部分分解生成Fe3O4,写出有关的化学方程式4FeO=Fe3O4+Fe.
②称取一定质量上述加热材料反应后的混合物(假定只含氯化钾一种钾盐)于烧杯中,用蒸馏水充分洗涤、过滤、干燥,固体质量减少了0.43g,在固体中继续加入过量的稀硫酸,微热让其充分反应,固体完全溶解得到的溶液中加入过量的NaOH溶液,经过滤、洗净、干燥,再在空气中充分灼烧得6.0 g棕色固体.求该加热材料反应前,铁和高氯酸钾的质量.(写出计算过程,结果保留2位有效数字)该加热材料反应前铁和高氯酸钾的质量分别为4.2g、0.80g.
| A. | 浓硫酸沾到皮肤上时,可立刻用大量的水冲洗,然后再涂上3%~5%的NaHCO3溶液 | |
| B. | 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志 | |
| C. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 | |
| D. | 闻任何化学药品的气味都不能将鼻子凑近药品 |
