题目内容
10.下列叙述正确的是( )| A. | 同周期元素中,随着原子序数的递增,原子半径逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 同一主族元素,随着原子序数的递增,其单质的熔沸点依次升高 | |
| D. | 随着卤素原子半径的增大,其气态氢化物稳定性逐渐减弱 |
分析 A.同周期从左向右原子半径减小;
B.同主族从上到下半径增大,非金属性减弱;
C.碱金属随着原子序数的递增,其单质的熔沸点降低;
D.卤族元素从上到下半径增大,非金属性减弱.
解答 解:A.同周期从左向右原子半径减小,则同周期元素中,随着原子序数的递增,原子半径逐渐减小,故A正确;
B.同主族从上到下半径增大,非金属性减弱,则ⅥA族元素的原子,其半径越大,越难得到电子,故B错误;
C.碱金属随着原子序数的递增,其单质的熔沸点降低,而卤素随着原子序数的递增,其单质的熔沸点依次升高,沸点变化规律与晶体类型有关,故C错误;
D.卤族元素从上到下半径增大,非金属性减弱,则随着卤素原子半径的增大,其气态氢化物稳定性逐渐减弱,故D正确;
故选AD.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
19.我国最新报道的高温超导体中,铊是组成成分之一.已知铊与铝是同族元素,关于铊的判断有错误的是( )
| A. | 氢氧化铊是两性氢氧化物 | B. | 铊能置换出盐酸中的氢 | ||
| C. | 铊是质软的银白色的金属 | D. | 铊能生成+3价的化合物 |
1.I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用.
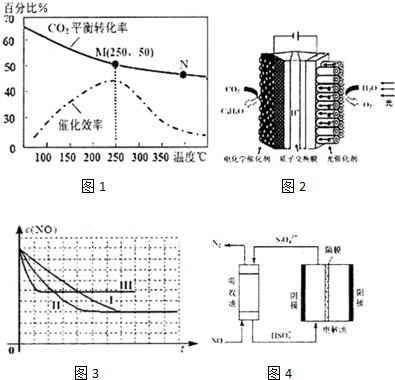
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)+CH2═CH2(g)+4H2O(g)△H=a kJ•mol-1
已知:H2(g)的燃烧热为285.8kJ•mol-1,CH2=CH2(g)的燃烧热为1411.0kJ•mol-1,H2O(g)=H2O(l)△H=-44.0kJ•mol-1,则a=-127.8kJ•mol-1.
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图1,下列有关说法不正确的是①②④(填序号)
①温度越高,催化剂的催化效率越高
②温发低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”.如图2是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O.阴极的电极反应式为:3CO2+18H++18e-=C3H8O+5H2O
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:2NO(g)+2CO(g)?2CO2(g)+N2(g).
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如3图:
①表中a=1.20×10-3.
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{c(NO)}{c(CO)}$=1,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,则K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$;.
(5)使用电化学法也可处理NO的污染,装置如图4.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.

(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)+CH2═CH2(g)+4H2O(g)△H=a kJ•mol-1
已知:H2(g)的燃烧热为285.8kJ•mol-1,CH2=CH2(g)的燃烧热为1411.0kJ•mol-1,H2O(g)=H2O(l)△H=-44.0kJ•mol-1,则a=-127.8kJ•mol-1.
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图1,下列有关说法不正确的是①②④(填序号)
①温度越高,催化剂的催化效率越高
②温发低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”.如图2是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O.阴极的电极反应式为:3CO2+18H++18e-=C3H8O+5H2O
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:2NO(g)+2CO(g)?2CO2(g)+N2(g).
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如3图:
| 编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | a | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | b |
②实验说明,该反应是放热反应(填“放热”或“吸热”).
③若在500℃时,投料$\frac{c(NO)}{c(CO)}$=1,NO的转化率为80%,则此温度时的平衡常数K=第一种情况:设c(NO)=1mol•L-1,则K=160,
第二种情况:设c(NO)=amol•L-1,则K=$\frac{160}{a}$,
第三种情况:设n(NO)=amol,容器的容积为V L,则K=$\frac{160V}{a}$;.
(5)使用电化学法也可处理NO的污染,装置如图4.已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:2HSO3-+2H++2e-=S2O42-+2H2O.吸收池中除去NO的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-.
18.食品安全日益受到人们的关注.下列食品能食用的是( )
| A. | 使用瘦肉精饲养的猪 | B. | 用着色剂染色的馒头 | ||
| C. | 用硫酸铜浸泡过粽叶的粽子 | D. | 用食盐水浸泡过的菠萝 |
5.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.如表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F. | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940kJ•mol-1 | B. | 1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | 485kJ•mol-1 |
15.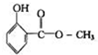 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )
①加成反应
②水解反应
③消去反应
④取代反应
⑤与NaHCO3反应放出CO2
⑥加聚反应.
 冬青油结构如图,它在一定条件下能发生的反应有:( )
冬青油结构如图,它在一定条件下能发生的反应有:( )①加成反应
②水解反应
③消去反应
④取代反应
⑤与NaHCO3反应放出CO2
⑥加聚反应.
| A. | ①②⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①②④ |
2.下列叙述能说明X的非金属性比Y强的是( )
| A. | X的气态氢化物比Y的气态氢化物稳定 | |
| B. | X原子的电子层数比Y原子的电子层数多 | |
| C. | Y的单质能将X从NaX的溶液中置换出来 | |
| D. | Y在暗处可与H2反应,X在加热条件下才能与H2反应 |
19.某研究性学习兴趣小组小诗、小坂两个同学为探究同周期元素性质递变规律时,他们准备了相关的实验用品(后面附:实验用品清单)并进行了任务分工.
小诗同学用不同的实验方法证明Na、Mg、Al的失电子能力的变化顺序,设计了如下方案,并记录了有关实验现象.
小坂同学为证明S、Cl得电子能力的变化顺序,事先也自行设计了一套实验方案:
附:实验用品清单
请根据上述材料,完成下列填空:
(1)请你为小诗、小坂两个同学核对所列的仪器清单中有没有缺少相关的仪器.
若有,则填“有”,并尽可能补全所缺少仪器的名称;若无,则填“无”有,试管;
(2)将与实验步骤对应的实验现象编号填写在下列表格中:
(3)写出镁与水反应的化学方程式:Mg+2H2O=Mg(OH)2+H2↑;
(4)小诗根据实验事实得出的实验结论是:金属活泼顺序为钠>镁>铝;
(5)请您帮忙小坂同学填写有关的实验现象和实验结论
小诗同学用不同的实验方法证明Na、Mg、Al的失电子能力的变化顺序,设计了如下方案,并记录了有关实验现象.
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向试管中滴加酚酞溶液 3将镁条投入稀盐酸中 4将铝条投入稀盐酸中 |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不是很剧烈,产生无色气体 D.有气体产生,溶液变成浅红色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 5.向新制Na2S溶液中滴加新制氯水 | 产生淡黄色沉淀 | 氯气的氧化性大于硫 |
| 试剂 | 金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液 |
| 仪器 | 表面皿,试管夹,镊子,小刀,玻璃片,砂纸 |
(1)请你为小诗、小坂两个同学核对所列的仪器清单中有没有缺少相关的仪器.
若有,则填“有”,并尽可能补全所缺少仪器的名称;若无,则填“无”有,试管;
(2)将与实验步骤对应的实验现象编号填写在下列表格中:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
(4)小诗根据实验事实得出的实验结论是:金属活泼顺序为钠>镁>铝;
(5)请您帮忙小坂同学填写有关的实验现象和实验结论
| 实验步骤 | 实验现象 | 实验结论 |
| 5、向新制Na2S溶液中滴加新制氯水 | 产生淡黄色沉淀 | 氯的氧化性大于硫 |