题目内容
20.Na、Mg、Al的金属性由强到弱的顺序是Na>Mg>Al.往Na、Mg、Al组成的混合物中加入足量水,充分反应后,产生的气体是H2(用化学式填写,下同);得到的溶液中含有的盐是NaAlO2;留下的固体中一定含有Mg.分析 同周期从左到右元素的金属性逐渐减弱;Na与水反应生成氢氧化钠,Al与氢氧化钠反应生成偏铝酸钠和氢气;Mg与水、NaOH都不反应,据此分析.
解答 解:Na、Mg、Al属于第三周期金属元素,同周期从左到右元素的金属性逐渐减弱,则金属性:Na>Mg>Al;往Na、Mg、Al组成的混合物中加入足量水,Na与水反应生成氢氧化钠和氢气,Al与氢氧化钠反应生成偏铝酸钠和氢气,所以产生的气体是氢气,溶液中溶质是NaAlO2;Mg与水、NaOH都不反应,则最后剩余的固体是Mg;
故答案为:Na>Mg>Al;H2;NaAlO2;Mg.
点评 本题考查了金属性的比较、常见金属元素的性质,题目难度不大,注意把握单质铝的性质既能与强酸反应又能与强碱反应.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 同周期元素中,随着原子序数的递增,原子半径逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 同一主族元素,随着原子序数的递增,其单质的熔沸点依次升高 | |
| D. | 随着卤素原子半径的增大,其气态氢化物稳定性逐渐减弱 |
11.将铜片放入盛有稀硫酸烧杯中,没有明显的现象,当加入(或通入)下列物质后(可以加热),铜片溶解,溶液变蓝且不会产生有毒气体的是( )
| A. | CuO | B. | O2 | C. | NaNO3 | D. | HCl |
8.短周期主族元素W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为4:3,Z 原子比X 原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z 的电负性大小顺序一定是Z>Y>W | |
| B. | Z 的氢化物分之间存在氢键 | |
| C. | Y、Z 形成的分子的中心原子可能采用sp3杂化 | |
| D. | WY2分子中σ键与π键的数目之比是2:1 |
15.肉桂酸在香精香料、食品添加剂、医药工业、美容、农药、有机合成等方面有着广泛应用.某同学查阅资料进行肉桂酸的合成并分析其纯度.合成原理和有关数据如下:
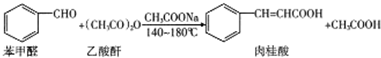
在三颈烧瓶中放入1.5mL(0.015mol)新蒸馏过的苯甲醛、4mL(0.036mol)新蒸馏过的乙酸酐以及研细的2.2g无水醋酸钠,加入2-3粒沸石,在石棉网上加热回流30min.
待反应物冷却后,加入10mL温水,改为水蒸气蒸馏蒸出未完全反应完的苯甲醛.再将烧瓶冷却,加入l0mL 10%氢氧化钠溶液.抽滤,将滤液倾入250mL烧杯中,冷却至室温,在揽拌下用浓盐酸酸化.冷却,抽滤,用少量冰水洗涤沉淀,抽干.粗产品在空气中晾干,产量约1.5g.
(1)某同学进行该实验时忘记加沸石,正确的操作为待反应物冷却后补加沸石.
(2)石棉网上冷凝回流时应使用球形冷凝管 仪器,回流的作用为提高反应物的转化率.
(3)加人过暈乙酸酐的目的是提高苯甲醛的转化率.
(4)加人10%NaOH溶液的作用是保证所有的肉桂酸转化为钠盐而溶解.
(5)冰水洗涤的作用是洗去肉桂酸中混有的NaCl杂质,同时降低肉桂酸的溶解度减少溶解损失,粗产品的进一步纯化可采用的方法是重结晶.
(6)肉桂酸的产率为67.6%.(保留三位有效数字)

| 名称 | 分子量 | 相对密度 | 熔点 | 沸点 | 溶解度 |
| 苯甲醛 | 106 | 1.04 | -26 | 179.62 | 微溶于水,可混溶于乙醇、乙醚、苯 |
| 乙酸酐 | 102 | 1.080 | -73.1 | 138.6 | 溶于乙醚,易水解形成乙酸. |
| 肉桂酸 | 148 | 1.247 | 135 | 300 | 微溶于水,可以溶于苯、丙酮、乙醚、乙醇等 |
待反应物冷却后,加入10mL温水,改为水蒸气蒸馏蒸出未完全反应完的苯甲醛.再将烧瓶冷却,加入l0mL 10%氢氧化钠溶液.抽滤,将滤液倾入250mL烧杯中,冷却至室温,在揽拌下用浓盐酸酸化.冷却,抽滤,用少量冰水洗涤沉淀,抽干.粗产品在空气中晾干,产量约1.5g.
(1)某同学进行该实验时忘记加沸石,正确的操作为待反应物冷却后补加沸石.
(2)石棉网上冷凝回流时应使用球形冷凝管 仪器,回流的作用为提高反应物的转化率.
(3)加人过暈乙酸酐的目的是提高苯甲醛的转化率.
(4)加人10%NaOH溶液的作用是保证所有的肉桂酸转化为钠盐而溶解.
(5)冰水洗涤的作用是洗去肉桂酸中混有的NaCl杂质,同时降低肉桂酸的溶解度减少溶解损失,粗产品的进一步纯化可采用的方法是重结晶.
(6)肉桂酸的产率为67.6%.(保留三位有效数字)
5.下列有关叙述不正确的是( )
| A. | 不需要通过化学反应就能从海水中获得食盐和淡水 | |
| B. | 潜水艇在紧急情况下可用过氧化钠供氧 | |
| C. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| D. | 工业上常用硅制造光导纤维;用铝粉还原一些金属氧化物来制金属 |
12.X、Y是第三周期的非金属元素,X原子半径比Y原子半径大,则下列叙述中正确的是( )
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
9.下列反应中,属于氧化还原反应且水只作氧化剂的是( )
| A. | SO3+H2O→H2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | 2 F2+2 H2O→4 HF+O2 | D. | 2 Al+6 H2O$\stackrel{△}{→}$2 Al(OH)3+3 H2↑ |
 小明设计的探究燃烧条件的实验如图所示.请回答下列问题.
小明设计的探究燃烧条件的实验如图所示.请回答下列问题.