题目内容
18.食品安全日益受到人们的关注.下列食品能食用的是( )| A. | 使用瘦肉精饲养的猪 | B. | 用着色剂染色的馒头 | ||
| C. | 用硫酸铜浸泡过粽叶的粽子 | D. | 用食盐水浸泡过的菠萝 |
分析 A.瘦肉精有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病;
B.着色剂对人体有害;
C.铜离子属于重金属,能使蛋白质失去活性;
D.食盐能抑制菠萝酶的活力;
解答 解:A.使用瘦肉精饲养的猪,轻则导致心律不整,严重一点就会导致心脏病,故A错误;
B.着色剂对人体有害,不能食用,故B错误;
C.铜离子属于重金属,能使蛋白质失去活性,所以不能用硫酸铜浸泡粽叶,故C错误;
D.用食盐水浸泡菠萝,就可以抑制菠萝酶对口腔粘膜和嘴唇的刺激,同时也会感到菠萝更加香甜了,故D正确;
故选D.
点评 本题考查的是某些化学品的性质与人体健康的关系,难度不大,注意知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶度积关系为( )
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgI>AgCl>Ag2S | D. | AgCl>AgI>Ag2S |
3.下列关于电解法精炼粗铜的叙述中,不正确的是( )
| A. | 粗铜板作阳极 | |
| B. | 电解时,阴极反应为Cu2++2e-=Cu | |
| C. | 电解铜的纯度可达99.95%~99.95% | |
| D. | 粗铜中所含的锌、镍、银等,电解后均以单质形式沉积槽底 |
10.下列叙述正确的是( )
| A. | 同周期元素中,随着原子序数的递增,原子半径逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 同一主族元素,随着原子序数的递增,其单质的熔沸点依次升高 | |
| D. | 随着卤素原子半径的增大,其气态氢化物稳定性逐渐减弱 |
8.短周期主族元素W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为4:3,Z 原子比X 原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z 的电负性大小顺序一定是Z>Y>W | |
| B. | Z 的氢化物分之间存在氢键 | |
| C. | Y、Z 形成的分子的中心原子可能采用sp3杂化 | |
| D. | WY2分子中σ键与π键的数目之比是2:1 |

 ;
;
 ),完成以邻甲基苯酚(
),完成以邻甲基苯酚( )和乙醇为原料制备合成
)和乙醇为原料制备合成 的路线流程图.
的路线流程图. .
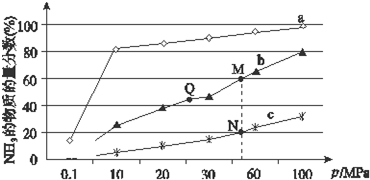
.
 CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.
CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.