题目内容
12.下列电离方程式正确的是( )| A. | NH4Cl=NH4++Cl- | B. | NaHSO4=Na++HSO42- | ||
| C. | H2CO3=2H++CO32- | D. | CH3COOH→CH3++COOH- |
分析 A.氯化铵为强电解质,完全电离出铵根离子、氯离子;
B.NaHSO4是强酸强碱酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子;
C.碳酸属于弱酸存在分步电离,电离过程是可逆过程;
D.CH3COOH是弱电解质,存在电离平衡,用“?”连接.
解答 解:A.氯化铵属于盐,完全电离出铵根离子和氯离子,电离方程式为:NH4Cl=NH4++Cl-,故A正确;
B.硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42-,故B错误;
C.碳酸属于弱酸存在分步电离,电离过程是可逆过程,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,故C错误;
D.CH3COOH是弱电解质,部分电离,电离方程式为:CH3COOH?CH3COO-+H+,故D错误;
故选A.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
2.在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中正确的是( )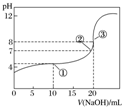

| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |
3.下列叙述正确的是( )
| A. | 单质分子中一定不存在共价键 | |
| B. | 气态物质中一定有共价键 | |
| C. | 在共价化合物中一定有共价键 | |
| D. | 由非金属元素组成的化合物中,一定不含离子键 |
7.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )
| A. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| B. | 0.1 mol F- 中含有的电子数等于0.9×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 电解饱和食盐水若产生2 g氢气,则转移的电子数目为2×6.02×1023 |
17.25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-amol/L,下列说法正确的是( )
| A. | a<7时,水的电离受到抑制 | B. | a>7时,水的电离受到抑制 | ||
| C. | a<7时,溶液的pH一定为a | D. | a>7时,溶液的pH一定为14-a |
4.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 D>C>A>B |
1.I2在KI溶液中存在下列平衡:I2 (aq)+I-(aq)?I3-(aq).测得不同温度下该反应的平衡常数如下表:( )
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1100 | 841 | 689 | 533 | 409 |
| A. | 反应I2 (aq)+I-(aq)?I3-(aq)的△H>0 | |
| B. | 其他条件不变,升高温度,溶液中c(I3-)减小 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时向溶液中加入少量KI固体,平衡常数K大于689 |
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
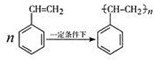
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题 制取 聚苯乙烯
制取 聚苯乙烯