题目内容
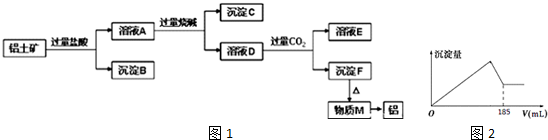
12.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子.用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:(1)请画出沉淀B中金属元素的原子结构示意图
 ;
;(2)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(3)请写出气体C与氯气发生氧化还原反应的化学方程式3Cl2+8NH3=N2+6NH4Cl.
分析 A与NaOH溶液反应,先观察到有白色沉淀B生成,后产生的气体能使湿润红色石蕊试纸变蓝色的气体C,气体不再产生时沉淀开始溶解,则气体C为NH3,白色沉淀为Al(OH)3,A中含有NH4+、Al3+,均为10电子的阳离子,沉淀恰好完全溶解时共用去NaOH的物质的量为0.050mol,由Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3.H2O、Al(OH)3+OH-=AlO2-+2H2O可知,NH4+、Al3+为1:1,则A中含有阴离子带2个单位负电荷,且与铵根离子、铝离子不反应,则阴离子为SO42-,则A为AlNH4(SO4)2,据此分析解答.
解答 解:A与NaOH溶液反应,先观察到有白色沉淀B生成,后产生的气体能使湿润红色石蕊试纸变蓝色的气体C,气体不再产生时沉淀开始溶解,则气体C为NH3,白色沉淀为Al(OH)3,A中含有NH4+、Al3+,均为10电子的阳离子,沉淀恰好完全溶解时共用去NaOH的物质的量为0.050mol,由Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3.H2O、Al(OH)3+OH-=AlO2-+2H2O可知,NH4+、Al3+为1:1,则A中含有阴离子带2个单位负电荷,且与铵根离子、铝离子不反应,则阴离子为SO42-,则A为AlNH4(SO4)2,
(1)沉淀B中金属元素为Al元素,Al的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2,沉淀B溶解在氢氧化钠溶液中的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)气体C与氯气发生氧化还原反应的化学方程式3Cl2+8NH3=N2+6NH4Cl,故答案为:3Cl2+8NH3=N2+6NH4Cl.
点评 本题考查无机物推断,为高频考点,明确元素化合物性质是解本题关键,根据物质特殊性质结合题给信息进行推断,注意氢氧化铝的两性及制取方法,题目难度不大.

| X | ||
| Y | Z |
| A. | Y的最高价氧化物对应水化物的酸性比Z的弱 | |
| B. | Y的气态氢化物的稳定性较Z的强 | |
| C. | 非金属性:X>Y>Z | |
| D. | 原子半径:Z>Y>X |
| A. | 盐酸>醋酸 | B. | 醋酸>盐酸 | C. | 盐酸=醋 | D. | 无法判断 |
| A. | 3:1 | B. | 4:1 | C. | 3:2 | D. | 7:2 |
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 标准状况下,32gSO2的体积约为22.4L | |
| D. | 物质的量浓度为1mol•L-1的K2SO4溶液中,含2NA个K+ |
| A. | 称量NaOH固体时动作过于缓慢 | B. | 向容量瓶中加水定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
 CO+3H2.
CO+3H2.
 .
.