题目内容
10.如图为周期表中短周期的一部分,若Z原子最外层电子数是其电子层数的2倍,则下列说法正确的是( )| X | ||
| Y | Z |
| A. | Y的最高价氧化物对应水化物的酸性比Z的弱 | |
| B. | Y的气态氢化物的稳定性较Z的强 | |
| C. | 非金属性:X>Y>Z | |
| D. | 原子半径:Z>Y>X |
分析 Z原子最外层电子数是其电子层数的2倍,若有2个电子层,则Z为C元素,X的位置没有元素,不符合题意;若Z有3个电子层,则最外层有6个电子,为S元素,X为F元素,Y为P元素,结合元素周期律与元素化合物性质解答.
解答 解:Z原子最外层电子数是其电子层数的2倍,若有2个电子层,则Z为C元素,X的位置没有元素,不符合题意;若Z有3个电子层,则最外层有6个电子,为S元素,X为F元素,Y为P元素,
A.Y为P元素,Z为S元素,P的最高价氧化物对应水化物的酸性比S的弱,故A正确;
B.Y为P元素,Z为S元素,P的气态氢化物的稳定性较S的弱,故B错误;
C.同周期自左而右非金属性增强,同主族从上到下非金属性减弱,非金属性:X>Z>Y,故C错误;
D.同周期自左而右原子半径减小,同主族从上到下原子半径增大,所以原子半径:Y>Z>X,故D错误,
故选A.
点评 本题考查了元素的位置、结构和性质的关系,题目难度不大,能根据题意正确判断元素是解本题的关键,要注意把握对应单质和化合物的性质.

练习册系列答案
相关题目
20.第三周期元素R,它的原子最外电子层达到稳定结构所所需的电子数少于次外层与最内层电子数之差,且等于最内层电子数的整数倍,关于R的叙述中正确的是( )
| A. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| B. | R的气态氢化物的水溶液具有强酸性 | |
| C. | R是金属元素 | |
| D. | R的气态氧化物不能在氧气中燃烧 |
1.下列与社会、生活有关的说法不正确的是( )
| A. | 绿色化学的核心是从源头上防止和消除化工生产对环境的污染 | |
| B. | 减少化石燃料的使用,有利于降低空气中pM2.5的数值 | |
| C. | “地沟油”禁止食用,但可以用来制柴油、肥皂等 | |
| D. | 淀粉、豆油、蛋白质都是天然高分子化合物 |
18.下列说法中正确的是( )
| A. | 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-═AgI↓ | |
| B. | NH4+的水解反应离子方程式:NH4++H2O?NH3•H2O+H+ | |
| C. | 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu | |
| D. | 某反应△H<0,则该反应在任意条件下均可自发进行 |
5.某主族元素R的最高正化合价与负化合价的代数和为4,由此可以判断( )
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
15.某饱和一元醇的结构简式如下,其系统命名是( )


| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
11.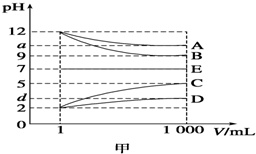 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
(1)根据pH的变化关系,写出物质的化学式:BNaOH,CHCl.
(2)写出A与C反应的离子方程式:NH3•H2O+H+═NH4++H2O.
 物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.
物质A~E都是由下表中的离子组成的,常温下将各物质的溶液从1mL稀释到1 000mL,pH的变化关系如图甲所示,其中A与D反应得到E.请回答下列问题.| 阳离子 | NH4+、H+、Na+ |
| 阴离子 | OH-、CH3COO-、Cl- |
(2)写出A与C反应的离子方程式:NH3•H2O+H+═NH4++H2O.
 ;
;