题目内容
13.利用铜片、锌片和200mL稀硫酸组成原电池,将化学能转化为电能,当铜片上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗,试计算:(1)理论上有多少克锌被溶解?有多少个电子通过了导线?
(2)原稀硫酸熔液的物质的量浓度.
分析 该原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,总反应为Zn+H2SO4=ZnSO4+H2↑,结合电极方程式以及总反应式解答该题.
解答 解:(1)已知产生3.36L氢气,则氢气的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,由2H++2e-=H2↑可知转移0.3mol电子,个数为0.3NA,则由负极反应Zn-2e-=Zn2+可知消耗0.15molZn,
m(Zn)=0.15mmol×65g/mol=9.75g,
答:理论上有9.75克锌被溶解,有0.3NA电子通过了导线;
(2)已知产生3.36L氢气,则氢气的物质的量为0.15mol,H原子守恒得n(H2SO4)=n(H2)=0.15mol,c(H2SO4)=$\frac{0.15mol}{0.2L}$=0.75mol/L,
答:原稀硫酸熔液的物质的量浓度为0.75mol/L.
点评 本题以原电池原理为载体考查了物质的量的有关计算,侧重于学生的分析、计算能力的考查,根据转移电子相等、原子守恒进行解答即可,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.1,2-二氯乙烯可以形成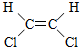 与
与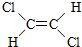 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
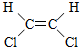 与
与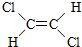 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 2-丁烯 | D. | 1-丁烯 |
4.化学与生活、社会发展息息相关,下列有关说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 | |
| C. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
1.常温时,有4种由水电离出的c(H+)均为1×10-13mol/L的溶液:①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水.有关上述溶液的比较中,正确的是( )
| A. | 向等体积的①、②溶液中分别加水稀释100倍后,溶液的pH:①<② | |
| B. | 将等体积的①、③溶液分别与足量铝粉反应,生成H2的物质的量相等 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:①>④ |
8.下列实验设计、操作或实验现象不合理的是( )
| A. | 取某试样溶液少量,加入KSCN溶液无明显现象,再滴入几滴氯水,若溶液显血红色,说明原试样中含Fe2+ | |
| B. | 淀粉溶液和稀硫酸共热后,加碱中和,再加少量银氨溶液水浴加热,有光亮的银镜生成 | |
| C. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共沸几分钟,然后加入足量稀硝酸,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
18.下列有关氧元素及其化合物的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:$\stackrel{18}{8}$O | |
| B. | 氧原子的结构示意图: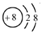 | |
| C. | 水分子的电子式: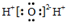 | |
| D. | 乙醛的结构简式:CH3COH |
5.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成
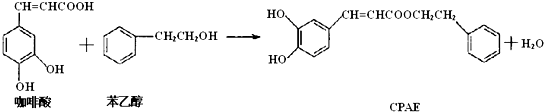
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 咖啡酸分子中所有原子不可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 1mol 苯乙醇在O2中完全燃烧,需消耗10molO2 | |
| D. | 1mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
2.把a、b、c、d 四块金属片浸人稀酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;c、d相连时,电子由c到d;a、c相连时c极上产生大量气泡;b、d相连时,d为负极.则四种金属的活动性顺序由强到弱的顺序为( )
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
3.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | Al--Al2O3--Al(OH)3--Na[Al(OH)4] | B. | Mg--MgCl2--Mg(OH)2--MgO | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Si--SiO2--H2SiO3--Na2SiO3 |