题目内容
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| B. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L氢气和氯气的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移电子数为NA |
分析 A.根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合原子构成判断,1个D2O分子中含电子数为10个;
B.根据n=$\frac{m}{M}$,结合1个氮气分子的含电子数为14计算分析;
C.根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算;
D.根据氧化还原反应在守恒分析,反应中电子转移依据氢气的物质的量计算.
解答 解:A.n=$\frac{18g}{20g/mol}$=0.9mol,所含的电子数为9NA,故A错误;
B.14g氮气含有的核外电子数=$\frac{14g}{28g/mol}$×2×7×NA=7NA,故B错误;
C.标准状况下,22.4L任意比的氢气和氯气的混合气体的物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,分子数为NA,故C正确;
D.铝与氢氧化钠溶液反应中氢元素化合价由+1价降低为0价,反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数应用,物质的量和微粒数的计算,题目难度不大,本题注意把握物质的状态、结构等特点,也是为易错点.

练习册系列答案
相关题目
4.下列是元素周期表的前三周期中的部分元素
(1)表中所标出的元素当中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ne;
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2 (大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2;其最高价氧化物对应水化物的化学式为H2SiO3.
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2 (大于/小于);
另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于 Br2 (大于/小于).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2 (大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2;其最高价氧化物对应水化物的化学式为H2SiO3.
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2 (大于/小于);
另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于 Br2 (大于/小于).
5.工业上可用下列装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)装置④的作用是过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流.
(5)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(6)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为24.0%(保留小数点后1位).
(7)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂B.
A.硝酸银溶液 B.氯化钡溶液
C.澄清石灰水 D.酸性高锰酸钾溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)装置④的作用是过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流.
(5)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(6)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(7)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂B.
A.硝酸银溶液 B.氯化钡溶液
C.澄清石灰水 D.酸性高锰酸钾溶液.
2.下列说法错误的是( )
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+和H2是氢元素的五种不同粒子 | |
| B. | 石墨和金刚石互为同位素,化学性质相似 | |
| C. | ${\;}_{1}^{1}$H和 ${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和 14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
19.下列关于硅及其化合物的叙述错误的是( )
| A. | 单质硅是良好的半导体材料 | B. | 硅胶常用作食品干燥剂 | ||
| C. | 二氧化硅坚硬但易溶于水 | D. | 玻璃、水泥、陶瓷都属于硅酸盐产品 |
6.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
(1)基态Cu2+的电子排布式为1s22s22p63s23p63d9,其M电子层的电子数为17.
(2)VSEPR理论认为价层电子对间互斥力(F)大小顺序:F(孤电子对间)>F(孤电子对-成键电子对)>F(成键电子对间),已知XeF4中Xe价层电子对数为6,其VSEPR模型为八面体,为使得价层电子对间的孤电子对斥力最小,预测XeF4分子中的键角应为90°.
(3)除NH3、H2O、HF外,同主族氢化物的沸点随周期数增大而升高的原因是同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大,沸点越高;
已知NH3、H2O、HF的氢键键能和结构如表:
则如图1H2O、HF、NH3沸点由高到低的顺序依次为:H2O>HF>NH3.
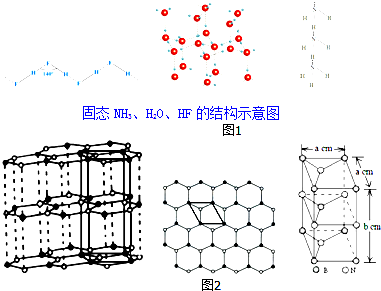
(4)石墨型BN呈白色,亦称“白石墨”.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”中B和N的杂化方式分别为sp2和sp2,白石墨的密度为$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3( 已知相对原子质量B:11 N:14 阿伏加德罗常数的数值用NA表示).
(1)基态Cu2+的电子排布式为1s22s22p63s23p63d9,其M电子层的电子数为17.
(2)VSEPR理论认为价层电子对间互斥力(F)大小顺序:F(孤电子对间)>F(孤电子对-成键电子对)>F(成键电子对间),已知XeF4中Xe价层电子对数为6,其VSEPR模型为八面体,为使得价层电子对间的孤电子对斥力最小,预测XeF4分子中的键角应为90°.
(3)除NH3、H2O、HF外,同主族氢化物的沸点随周期数增大而升高的原因是同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大,沸点越高;
已知NH3、H2O、HF的氢键键能和结构如表:
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

(4)石墨型BN呈白色,亦称“白石墨”.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”中B和N的杂化方式分别为sp2和sp2,白石墨的密度为$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3( 已知相对原子质量B:11 N:14 阿伏加德罗常数的数值用NA表示).
