题目内容
元素周期表是学习化学的重要工具,它隐含许多信息和规律.下面所列是五种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色(用相应的元素符号完成下列空白)
(1)B元素在元素周期表中的位置 ,上述八种元素的最高价氧化物对应的水化物中酸性最强的是 .A离子的结构示意图 .
(2)用电子式表示A、D形成化合物的过程: .H、E形成原子个数比为1:1的化合物的电子式为 ,含有的化学键类型为 .C2D2的电子式为 .
(3)下列说法能说明D的非金属性比C强的选项
①H2CO4比HDO稳定
②HDO4比H2CO4酸性强
③C2-比D-易被氧化
④HD比H2C稳定
⑤铜与HD不反应,但能与浓H2CO4反应
⑥铁与D2加热生成FeD3,铁与C加热生成FeC
⑦C原子与D原子电子层数相同,D原子半径小于C原子.
A、全部 B、②③④⑥⑦C、①②④⑤⑥D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为 .(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程 氧化剂与还原剂的质量之比 .
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置
(2)用电子式表示A、D形成化合物的过程:
(3)下列说法能说明D的非金属性比C强的选项
①H2CO4比HDO稳定
②HDO4比H2CO4酸性强
③C2-比D-易被氧化
④HD比H2C稳定
⑤铜与HD不反应,但能与浓H2CO4反应
⑥铁与D2加热生成FeD3,铁与C加热生成FeC
⑦C原子与D原子电子层数相同,D原子半径小于C原子.
A、全部 B、②③④⑥⑦C、①②④⑤⑥D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:F原子中无中子,则F是H元素;
G最高正价数与负价数相等,且最外层电子数是次外层的二倍,最外层电子数不超过8,则其次外层是K层,则G是C元素;
H元素单质焰色反应呈黄色,则H是Na元素;
A的主要化合价为+2价,则A位于第IIA族;
B的主要化合价为+3价,则B位于第IIIA族;
C的主要化合价为+6、-2价,则C位于第VIA族,且为短周期元素,则C是S元素;
B的原子半径小于A而大于C,且为短周期元素,则A是Mg元素;
B是Al元素;
E的化合价为-2价,为第VIA族元素,且为短周期元素,所以E是O元素;
D的主要化合价为-1价,为第VIIA族元素,其原子半径大于E,则D是Cl元素,
再结合原子结构、元素周期律来分析解答.
G最高正价数与负价数相等,且最外层电子数是次外层的二倍,最外层电子数不超过8,则其次外层是K层,则G是C元素;
H元素单质焰色反应呈黄色,则H是Na元素;
A的主要化合价为+2价,则A位于第IIA族;
B的主要化合价为+3价,则B位于第IIIA族;
C的主要化合价为+6、-2价,则C位于第VIA族,且为短周期元素,则C是S元素;
B的原子半径小于A而大于C,且为短周期元素,则A是Mg元素;
B是Al元素;
E的化合价为-2价,为第VIA族元素,且为短周期元素,所以E是O元素;
D的主要化合价为-1价,为第VIIA族元素,其原子半径大于E,则D是Cl元素,
再结合原子结构、元素周期律来分析解答.
解答:
解:F原子中无中子,则F是H元素;
G最高正价数与负价数相等,且最外层电子数是次外层的二倍,最外层电子数不超过8,则其次外层是K层,则G是C元素;
H元素单质焰色反应呈黄色,则H是Na元素;
A的主要化合价为+2价,则A位于第IIA族;
B的主要化合价为+3价,则B位于第IIIA族;
C的主要化合价为+6、-2价,则C位于第VIA族,且为短周期元素,则C是S元素;
B的原子半径小于A而大于C,且为短周期元素,则A是Mg元素;
B是Al元素;
E的化合价为-2价,为第VIA族元素,且为短周期元素,所以E是O元素;
D的主要化合价为-1价,为第VIIA族元素,其原子半径大于E,则D是Cl元素,
(1)B是Al元素,位于第三周期第IIIA族,上述八种元素的最高价氧化物对应的水化物中酸性最强的是高氯酸,其化学式为HClO4,A是镁元素,其离子核内有12个质子、核外有10个电子,其离子结构示意图为 ,故答案为:第三周期第ⅢA族;HClO4;
,故答案为:第三周期第ⅢA族;HClO4; ;
;
(2)A是Mg元素、D是Cl元素,二者通过得失电子形成离子键,所以氯化镁的形成过程为: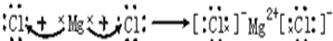 ,H、E形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在一对共用电子,所以过氧化钠的电子式为
,H、E形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在一对共用电子,所以过氧化钠的电子式为
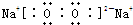 ,含有的化学键为离子键和非极性键;
,含有的化学键为离子键和非极性键;
S2Cl2分子中各原子最外层均满足8电子稳定结构,结合原子结构写出电子式为: ,
,
故答案为: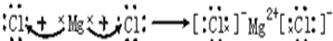 ;
;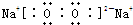 ;离子键和非极性键;
;离子键和非极性键; ;
;
(3)①元素的非金属性越强,其氢化物越稳定,H2CO4、HDO不是其相应元素的氢化物,所以H2CO4比HDO稳定不能说明Cl非金属性大于S,故错误;
②元素的非金属性越强,其最高价氧化物的水化物酸性元素,HDO4比H2CO4酸性强说明Cl元素的非金属性大于S,故正确;
③元素的非金属性越强,其简单阴离子越稳定,C2-比D-易被氧化,说明Cl元素的非金属性大于S,故正确;
④元素的非金属性越强,其氢化物越稳定,HD比H2C稳定说明Cl元素比S元素非金属性强,故正确;
⑤铜与HD不反应,但能与浓H2CO4反应,不能说明Cl的非金属性大于S,故错误;
⑥元素的非金属性越强,其单质的氧化性越强,铁与D2加热生成FeD3,铁与C加热生成FeC,说明Cl元素的非金属性大于S,故正确;
⑦同一周期元素中,原子半径随着原子序数的增大而减小,元素的非金属性随着原子序数的增大而增强,C原子与D原子电子层数相同,D原子半径小于C原子,所以能证明Cl元素的非金属性大于S,故错误;
故选B;
(4)A、B、C、D、E形成的简单离子分别是Mg2+、Al3+、S2-、Cl-、O2-,离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以这几种离子半径大小顺序是S2->Cl->O2->Mg2+>Al3+,故答案为:S2->Cl->O2->Mg2+>Al3+;
(5)Na的最高价氧化物对应水化物是NaOH,在加热条件下S和NaOH溶液反应,若有3mol的S参与反应,转移4NA的电子,说明有2molS得电子、1mol硫失电子,该反应生成硫化钠、亚硫酸钠和水,其硫化钠和亚硫酸钠的物质的量之比为2:1,则该反应离子方程式为3S+6OH-
2S2-+SO32-+3H2O,氧化剂与还原剂的质量之比2:1,
故答案为:3S+6OH-
2S2-+SO32-+3H2O;2:1.
G最高正价数与负价数相等,且最外层电子数是次外层的二倍,最外层电子数不超过8,则其次外层是K层,则G是C元素;
H元素单质焰色反应呈黄色,则H是Na元素;
A的主要化合价为+2价,则A位于第IIA族;
B的主要化合价为+3价,则B位于第IIIA族;
C的主要化合价为+6、-2价,则C位于第VIA族,且为短周期元素,则C是S元素;
B的原子半径小于A而大于C,且为短周期元素,则A是Mg元素;
B是Al元素;
E的化合价为-2价,为第VIA族元素,且为短周期元素,所以E是O元素;
D的主要化合价为-1价,为第VIIA族元素,其原子半径大于E,则D是Cl元素,
(1)B是Al元素,位于第三周期第IIIA族,上述八种元素的最高价氧化物对应的水化物中酸性最强的是高氯酸,其化学式为HClO4,A是镁元素,其离子核内有12个质子、核外有10个电子,其离子结构示意图为
 ,故答案为:第三周期第ⅢA族;HClO4;
,故答案为:第三周期第ⅢA族;HClO4; ;
;(2)A是Mg元素、D是Cl元素,二者通过得失电子形成离子键,所以氯化镁的形成过程为:
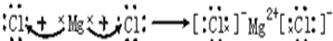 ,H、E形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在一对共用电子,所以过氧化钠的电子式为
,H、E形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在一对共用电子,所以过氧化钠的电子式为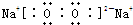 ,含有的化学键为离子键和非极性键;
,含有的化学键为离子键和非极性键;S2Cl2分子中各原子最外层均满足8电子稳定结构,结合原子结构写出电子式为:
 ,
,故答案为:
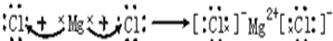 ;
;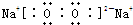 ;离子键和非极性键;
;离子键和非极性键; ;
;(3)①元素的非金属性越强,其氢化物越稳定,H2CO4、HDO不是其相应元素的氢化物,所以H2CO4比HDO稳定不能说明Cl非金属性大于S,故错误;
②元素的非金属性越强,其最高价氧化物的水化物酸性元素,HDO4比H2CO4酸性强说明Cl元素的非金属性大于S,故正确;
③元素的非金属性越强,其简单阴离子越稳定,C2-比D-易被氧化,说明Cl元素的非金属性大于S,故正确;
④元素的非金属性越强,其氢化物越稳定,HD比H2C稳定说明Cl元素比S元素非金属性强,故正确;
⑤铜与HD不反应,但能与浓H2CO4反应,不能说明Cl的非金属性大于S,故错误;
⑥元素的非金属性越强,其单质的氧化性越强,铁与D2加热生成FeD3,铁与C加热生成FeC,说明Cl元素的非金属性大于S,故正确;
⑦同一周期元素中,原子半径随着原子序数的增大而减小,元素的非金属性随着原子序数的增大而增强,C原子与D原子电子层数相同,D原子半径小于C原子,所以能证明Cl元素的非金属性大于S,故错误;
故选B;
(4)A、B、C、D、E形成的简单离子分别是Mg2+、Al3+、S2-、Cl-、O2-,离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以这几种离子半径大小顺序是S2->Cl->O2->Mg2+>Al3+,故答案为:S2->Cl->O2->Mg2+>Al3+;
(5)Na的最高价氧化物对应水化物是NaOH,在加热条件下S和NaOH溶液反应,若有3mol的S参与反应,转移4NA的电子,说明有2molS得电子、1mol硫失电子,该反应生成硫化钠、亚硫酸钠和水,其硫化钠和亚硫酸钠的物质的量之比为2:1,则该反应离子方程式为3S+6OH-
| ||
故答案为:3S+6OH-
| ||
点评:本题考查了元素位置结构性质的相互关系应用,涉及电子式的书写、氧化还原反应、离子半径大小比较、非金属性强弱的判断方法等知识点,这些知识点都是学习重点,知道元素金属性、非金属性强弱的判断方法有哪些.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
下列离子方程式不正确的是( )
| A、三氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
| B、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
| C、在Mn2+溶液中加入HNO3再加入PbO2得紫红色溶液:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| D、将0.1mol/L Na2CO3溶液数滴缓缓滴入O.1mol/L 25mL盐酸中2H++CO32-=CO2↑+H2O |
某有机物的结构简式为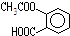 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚 ⑧加聚.
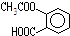 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥中和 ⑦缩聚 ⑧加聚.
| A、只有①②④⑤ |
| B、只有①②④⑤⑥ |
| C、只有①②④⑤⑥⑦ |
| D、只有①②④⑤⑥⑧ |
 某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.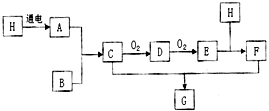 已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸:
已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸: