题目内容
将由铁粉、氧化铁粉末和氧化铜粉末组成的混合物溶于110mL 2mol/L的H2SO4中,完全反应后,得氢气896mL(标况).将反应物过滤,经干燥后得滤渣1.28g.滤液中的金属离子全部是Fe2+,将滤液稀释至200mL,再从中取出50mL,向其中逐滴加入1mol/L的NaOH溶液,边加边振荡,当加至20mL时溶液开始出现沉淀.试求:
(1)原混合物中CuO、Fe2O3各为多少g?
(2)稀释后的200mL滤液中Fe2+的物质的量浓度是多少?
(1)原混合物中CuO、Fe2O3各为多少g?
(2)稀释后的200mL滤液中Fe2+的物质的量浓度是多少?
考点:有关混合物反应的计算
专题:计算题
分析:固体完全反应,滤液中的金属离子全部是Fe2+,则炉渣1.28g为Cu的质量,向滤液稀释至200mL,再从中取出50mL,加入1mol/L NaOH溶液至20mL时开始出现沉淀,说明固体与稀硫酸反应后稀硫酸有剩余,滤液中溶质为H2SO4、FeSO4,滤液稀释后c(H+)=
=0.4mol/L,
(1)根据n=
计算1.28gCu的物质的量,根据Cu原子守恒可知n(CuO)=n(Cu),再根据m=nM计算CuO的质量;
参加反应的H2SO4中的H元素转化到氢气、水中,根据H原子守恒计算混合物中O原子物质的量,根据混合物中O原子守恒计算Fe2O3的物质的量,进而计算其质量;
(2)稀释后的滤液为H2SO4、FeSO4混合溶液,溶液中硫酸根物质的量不变,利用稀释定律计算稀释后c(SO42-),根据电荷守恒可知:c(H+)+2c(Fe2+)=2c(SO42-),据此计算.
| 20mL×1mol/L |
| 50mL |
(1)根据n=
| m |
| M |
参加反应的H2SO4中的H元素转化到氢气、水中,根据H原子守恒计算混合物中O原子物质的量,根据混合物中O原子守恒计算Fe2O3的物质的量,进而计算其质量;
(2)稀释后的滤液为H2SO4、FeSO4混合溶液,溶液中硫酸根物质的量不变,利用稀释定律计算稀释后c(SO42-),根据电荷守恒可知:c(H+)+2c(Fe2+)=2c(SO42-),据此计算.
解答:
解:固体完全反应,滤液中的金属离子全部是Fe2+,则炉渣1.28g为Cu的质量,向滤液稀释至200mL,再从中取出50mL,加入1mol/L NaOH溶液至20mL时开始出现沉淀,说明固体与稀硫酸反应后稀硫酸有剩余,滤液中溶质为H2SO4、FeSO4,滤液稀释后c(H+)=
=0.4mol/L,
(1)1.28gCu的物质的量=
=0.02mol,根据Cu原子守恒可知n(CuO)=n(Cu)=0.02mol,故CuO的质量=0.02mol×80g/mol=1.6g;
剩余硫酸的物质的量=0.4mol/L×0.2L×
=0.04mol,原溶液中硫酸的物质的量=2mol/L×0.11L=0.22mol,故参加反应的硫酸为0.22mol-0.04mol=0.18mol,
参加反应的H2SO4中的H元素转化到氢气、水中,根据H原子守恒,n(H2O)+n(H2)=n反应(H2SO4),即n(H2O)=0.18mol-
=0.14mol,故混合物中氧原子物质的量=0.14mol,根据混合物中O原子守恒,n(CuO)+3n(Fe2O3)=n(O),故n(Fe2O3)=
×(0.14mol-0.02mol)=0.04mol,故m(Fe2O3)=0.04mol×160g/mol=6.4g,
答:原混合物中CuO的质量为1.6g、Fe2O3的质量为6.4g;
(2)稀释后的滤液为H2SO4、FeSO4混合溶液,溶液中硫酸根物质的量不变,稀释后c(SO42-)=
=1.1mol/L,根据电荷守恒可知:c(H+)+2c(Fe2+)=2c(SO42-),即:0.4mol/L+2c(Fe2+)=2×1.1mol/L,解得c(Fe2+)=0.9mol/L,
答:稀释后的200毫升滤液中Fe2+的摩尔浓度是0.9mol/L.
| 20mL×1mol/L |
| 50mL |
(1)1.28gCu的物质的量=
| 1.28g |
| 64g/mol |
剩余硫酸的物质的量=0.4mol/L×0.2L×
| 1 |
| 2 |
参加反应的H2SO4中的H元素转化到氢气、水中,根据H原子守恒,n(H2O)+n(H2)=n反应(H2SO4),即n(H2O)=0.18mol-
| 0.896L |
| 22.4L/mol |
| 1 |
| 3 |
答:原混合物中CuO的质量为1.6g、Fe2O3的质量为6.4g;
(2)稀释后的滤液为H2SO4、FeSO4混合溶液,溶液中硫酸根物质的量不变,稀释后c(SO42-)=
| 0.11L×2mol/L |
| 0.2L |
答:稀释后的200毫升滤液中Fe2+的摩尔浓度是0.9mol/L.
点评:本题考查混合物计算,本题注意从溶液存在的离子判断物质反应的程度,利用守恒的方法计算,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、同分异构现象的广泛存在是造成有机物种类繁多的唯一原因 |
| B、乙烷在光照下与氯气反应生成的一氯代烃只有一种 |
| C、分子式为CH4O和C2H6O的物质一定互为同系物 |
| D、有机物结构中碳原子通过单键连接,剩余价键均与氢原子结合都属于烷烃 |
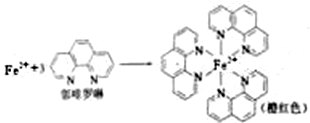 已知:
已知:
 实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液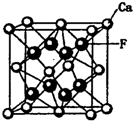 碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:
碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题: