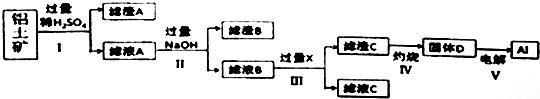
题目内容
6.在MgCl2溶液中滴加少量NaOH溶液,现象为生成白色沉淀,继续加入过量的NaOH溶液,现象为沉淀不溶解.分析 氯化镁溶液中加入氢氧化钠溶液会反应生成氢氧化镁白色沉淀;氢氧化镁不溶液氢氧化钠,以此解答该题.
解答 解:在MgCl2 溶液中滴加少量NaOH溶液,反应的现象为:生成白色沉淀,反应的离子方程式Mg2++2OH-=Mg(OH)2↓;继续加入氢氧化钠溶液,氢氧化镁是碱,不溶于氢氧化钠溶液中,反应的现象是沉淀不消失,
故答案为:生成白色沉淀;沉淀不溶解.
点评 本题考查氯化镁知识,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,提高学生学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.利用如图所示装置可以将铜牌变为银牌,即在铜牌表面电镀一层银.下列有关说法中正确的是( )
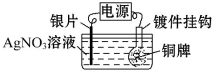

| A. | 通电后,Ag+向阳极移动 | |
| B. | 银片与电源负极相连 | |
| C. | 该电解池的阴极反应可表示为Ag++e-═Ag | |
| D. | 当电镀一段时间后,将电源反接,铜牌可恢复如初 |
17.常温下,某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为5:2,用石墨作电极电解该混合溶液时,根据电解产物,可分为三个阶段,下列叙述不正确的是( )
| A. | 溶液pH不断增大,最后为7 | B. | 阳极先析出Cl2,后析出O2 | ||
| C. | 阴极始终只析出H2 | D. | 电解最后阶段为电解水 |
14.常温下向下列溶液中通入足量CO2,溶液中一直没有明显变化的是( )
| A. | 饱和Na2CO3溶液 | B. | NaOH稀溶液 | C. | 饱和Ca(OH)2溶液 | D. | CaCl2溶液 |
1.标准状况下,11.85克金属镁放入足量的盐酸溶液中,生成11.2L氢气.则金属镁中所含的杂质是( )
| A. | Al | B. | Na | C. | Zn | D. | Fe |
15.下列不含有配位键的是( )
| A. | NH4Cl | B. | Na2CO3 | C. | CuSO4•5H2O | D. | [Co(NH3)6]Cl3 |
16.下列物质间的转化能一步实现的是( )
| A. | Na2CO3-→NaOH | B. | CaCO3-→Ca(OH)2 | C. | NaNO3-→NaCl | D. | CuO-→Cu(OH)2 |