题目内容
1.标准状况下,11.85克金属镁放入足量的盐酸溶液中,生成11.2L氢气.则金属镁中所含的杂质是( )| A. | Al | B. | Na | C. | Zn | D. | Fe |
分析 假设金属都为+2价,根据电子转移守恒计算金属物质的量,根据M=$\frac{m}{n}$计算金属混合物的平衡相对原子质量,利用平均值法判断,若金属不反应时,其相对原子质量视作无穷大.
解答 解:11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,由电子转移守恒可知金属总物质的量为0.5mol,则金属混合物的平均相对质量为=$\frac{11.85}{0.5}$=23.7,
镁的相对分子量为24,所以另一种金属应比23.7小且能与盐酸反应生成氢气,+2价的铝的相对原子质量18,Na为+2甲时,相对原子质量为46、Zn与Fe的相对原子质量分别为65、56,只有Al符合,
故选A.
点评 本题考查混合物的计算,题目难度中等,本题利用平均值法计算,侧重考查学生分析计算能力,注意化合价与相对原子质量的关系,金属与盐酸不反应时,其相对原子质量视作无穷大.

练习册系列答案
相关题目
11.在强酸性溶液中,可以大量共存的离子组是( )
| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、CO32-、NO3- | ||
| C. | Na+、Ag+、SO42-、Cl- | D. | Al3+、Fe3+、NO3-、SO42- |
12.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 常温下,甲基橙呈红色的溶液中:Na+、NH4+、SO42-、CH3COO- | |
| B. | 滴入酚酞试液显红色的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol/L的溶液:NH4+、K+、CO32-、Cl- | |
| D. | 含有大量HCO3-的溶液:K+、Al3+、Cl-、Na+ |
9.下列说法或有关化学用语的表达正确的是( )
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 基态Fe原子的外围电子排布图为 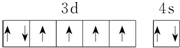 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 根据原子核外电子排布的特点,在Fe元素周期表中位于ds区 |
16.下列有关蛋白质的叙述不正确的是( )
①向蛋白质溶液里加浓(NH4)2SO4溶液可提纯蛋白质
②蛋白质的分子能透过半透膜
③蛋白质水解的最终产物是氨基酸
④温度越高,酶对某些化学反应的催化效率越高
⑤任何结构的蛋白质遇到浓HNO3都会变黄色.
①向蛋白质溶液里加浓(NH4)2SO4溶液可提纯蛋白质
②蛋白质的分子能透过半透膜
③蛋白质水解的最终产物是氨基酸
④温度越高,酶对某些化学反应的催化效率越高
⑤任何结构的蛋白质遇到浓HNO3都会变黄色.
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
13.下列说法正确的是( )
①极性分子一定含有极性键,非极性分子一定含有非极性键
②极性分子中一定不含有非极性键,非极性分子中可能含有极性键
③N2O和CO2是互为等电子体,因此每个分子均含有2个π 键,且中心原子均为sp杂化
④丙酮的沸点为57℃高于丁烷的沸点为-0.5℃是由于丙酮分子间有氢键
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低与氢键有关.
①极性分子一定含有极性键,非极性分子一定含有非极性键
②极性分子中一定不含有非极性键,非极性分子中可能含有极性键
③N2O和CO2是互为等电子体,因此每个分子均含有2个π 键,且中心原子均为sp杂化
④丙酮的沸点为57℃高于丁烷的沸点为-0.5℃是由于丙酮分子间有氢键
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低与氢键有关.
| A. | ③⑤ | B. | ②④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
10. 黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )
黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )
 黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )
黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 20种 |
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答: