题目内容
16.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
分析 A、氯水中含有大量的氯气分子,导致氯水显黄绿色;
B、氯水中的氯离子能与硝酸银发生复分解反应;
C、氯水中有酸,酸电离生成的H+能与NaHCO3固体反应;
D、次氯酸具有强氧化性,能氧化有色布条;
解答 解:A、因氯水中含有大量的氯气分子,导致氯水显黄绿色,和氯气有关,故A错误;
B、因氯水中的盐酸电离生成Cl-,氯离子能与硝酸银发生复分解反应生成氯化银白色沉淀,和氯离子有关,故B正确;
C、因氯水中有盐酸和次氯酸,均可电离生成H+,H+能与NaHCO3固体反应生成二氧化碳气体,则会有无色气泡出现,与新制氯水中的氢离子有关系,故C正确;
D、次氯酸具有强氧化性,能氧化有色布条,故D正确;
故选A.
点评 本题考查氯水的成分及氯气的化学性质、次氯酸的化学性质,明确氯水的成分是解答本题的关键,并熟悉各微粒的性质来解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
| A. | ①④⑥⑦⑧ | B. | ③④⑤⑥⑦ | C. | ①④⑤⑥⑦⑧ | D. | 全部 |
4.某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.下列有关说法正确的是( )
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
8.下列有关物质性质的判断正确的是( )
| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
5.化学工业的很多领域都要用到浓硫酸.工业上接触法制硫酸的简单流程如图1.回答有关问题:
(1)下列生产过程中,可用到硫酸的是BCD;
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸纳”的合成
C.铅蓄电池的生产 D.普钙(磷酸二氢钙和硫酸钙)的制备
(2)根据下表信息,结合工业生产实际,判断最适合SO2反应生成SO3的生产条件是400℃,0.1MPa.
(3)由沸腾炉排出的炉渣中含有Fe203、CuO、CuS04(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度变化如表:
己知CuS04在低于660℃时不会分解,请简要分析上表中CuS04的质最分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(4)用1t黄铁矿(FeS2的质量分数为36%)接触法制硫酸,硫酸的产率为65%,则通过列式计算最后能生产出98%的浓硫酸的质量为0.39t.
(5)某研究小组用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图2所示.a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.图中a表示阴(填“阴”或“阳”)离子交换膜.A〜E分别代表生产中的原料或产品,其中A为硫酸溶液,则D为NaOH溶液.阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.

(1)下列生产过程中,可用到硫酸的是BCD;
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸纳”的合成
C.铅蓄电池的生产 D.普钙(磷酸二氢钙和硫酸钙)的制备
(2)根据下表信息,结合工业生产实际,判断最适合SO2反应生成SO3的生产条件是400℃,0.1MPa.
 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)用1t黄铁矿(FeS2的质量分数为36%)接触法制硫酸,硫酸的产率为65%,则通过列式计算最后能生产出98%的浓硫酸的质量为0.39t.
(5)某研究小组用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图2所示.a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.图中a表示阴(填“阴”或“阳”)离子交换膜.A〜E分别代表生产中的原料或产品,其中A为硫酸溶液,则D为NaOH溶液.阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.
6.X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,X与W、Y与R分别同主族.Z在短周期元素中金属性最强,W元素原子的次外层电子数为最外层电子数的2倍,R的原子序数是Y的2倍,下列叙述错误的是( )
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
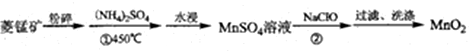
 .
.