题目内容
8.下列有关物质性质的判断正确的是( )| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
分析 A、晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体;
B、水分子间存在氢键,所以沸点异常高;
C、离子所带电荷越多、离子半径越小,晶格能越大;
D、非金属性:F>Cl,对应氢化物越稳定.
解答 解:A、晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>CO2,故A错误;
B、水分子间存在氢键,所以沸点异常高,所以沸点:H2O>H2S,故B错误;
C、离子所带电荷相同,Ca+半径大于Na+半径,则晶格能:CaCl<NaCl,故C正确;
D、非金属性:F>Cl,对应氢化物越稳定,所以热稳定性:HF>HCl,故D错误;
故选C.
点评 本题考查熔沸点高低比较、晶格能、晶体类型与性质,关键是理解掌握晶体类型与熔沸点、硬度关系及判断方法,分子晶体熔沸点与分子间作用力和氢键有关.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
16.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
13.N2和H2在一定条件下反应的热化学方程式为N2(g)+3H2(g)?2NH2(g)△H=-92KJ/mol,已知H-H键的键能为436kJ/mol.N-H键的键能为391kJ/mol,则N=N键的键能是( )
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
17. 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
i.打开弹簧夹,缓慢通入N2,并保持后续反应均在N2氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•L-1KNO3酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物
质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在NO3-、NH4+和Fe2+.
(1)通入N2并保持后续反应均在N2 氛围中进行的实验目的是避免空气中氧气对Fe与NO3-离子反应的干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)用K3[Fe(CN)6]检验滤液中Fe2+的实验方案是取滤液,加入几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,证明滤液中存Fe2+,.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述KNO3溶液继续设计如下实验,探究碳粉的作用
③关于碳粉的作用,还可以提出的假设是碳粉作为催化剂,提高脱除硝酸盐反应速率.
 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:i.打开弹簧夹,缓慢通入N2,并保持后续反应均在N2氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•L-1KNO3酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物
质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在NO3-、NH4+和Fe2+.
(1)通入N2并保持后续反应均在N2 氛围中进行的实验目的是避免空气中氧气对Fe与NO3-离子反应的干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)用K3[Fe(CN)6]检验滤液中Fe2+的实验方案是取滤液,加入几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,证明滤液中存Fe2+,.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述KNO3溶液继续设计如下实验,探究碳粉的作用
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入 碳粉一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定NO3-浓度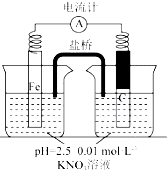 | Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
18.下列说法正确的是( )
| A. | 实验时皮肤受碱腐蚀,先用大量水冲洗,再用2%醋酸溶液或硼酸溶液洗,最后用水冲洗 | |
| B. | 萃取操作时,要快速振摇分液漏斗,放气时支管口不能对着人,也不能对着火 | |
| C. | 淀粉溶液中加入稀硫酸,加热后再加入适量银氨溶液,水浴加热,可以判断淀粉是否水解 | |
| D. | 液态溴乙烷中加入NaOH溶液共热几分钟,然后滴加AgNO3溶液,可以检验溴乙烷中含溴元素 |
 一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:
一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:

 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +2NaCl+2H2O
+2NaCl+2H2O .
. 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题: 甲、乙、丙三种物质之间有如下转化关系(如图):
甲、乙、丙三种物质之间有如下转化关系(如图):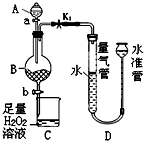 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).