题目内容
2.以下微粒含配位键的是( )①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3⑦H3O+ ⑧[Ag(NH3)2]OH.
| A. | ①④⑥⑦⑧ | B. | ③④⑤⑥⑦ | C. | ①④⑤⑥⑦⑧ | D. | 全部 |
分析 在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,据此分析解答.
解答 解:①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键,故正确;
②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键,故错误;
③OH-电子式为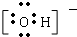 ,无空轨道,OH-不含有配位键,故错误;
,无空轨道,OH-不含有配位键,故错误;
④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键,故正确;
⑤Fe(CO)3中Fe原子提供空轨道,CO提供孤对电子,可以形成配位键,故正确;
⑥SCN-的电子式 ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,故正确;
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,故正确;
⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键,故正确;
⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,[Ag(NH3)2]OH含有配位键,故正确;
故选C.
点评 本题考查配位键的判断,明确配位键的形成是解本题关键,题目难度中等.注意配位键形成的条件,一方要提供空轨道,另一方提供孤电子对.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
12.下列说法正确的是( )
| A. | 钾(K)原子基态的原子结构示意图为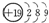 | |
| B. | Ca2+电子排布式为1s22s22p63s23p64s2 | |
| C. | 原子核内有10个中子的氧原子可表示为${\;}_{8}^{16}$O | |
| D. | H2O分子的电子式为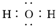 |
13.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硫酸锶(SrSO4)是难溶于水的白色固体 |
10.已知短周期元素的离子 aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
17.下列化合物中,既含有离子键又含有共价键的是( )
| A. | H2O2 | B. | Na2O | C. | CO2 | D. | NaOH |
7.硝酸在反应中只表现强氧化性的反应是( )
| A. | C与浓HNO3反应 | B. | Cu与浓HNO3反应 | C. | Cu与稀HNO3反应 | D. | Mg(OH)2与HNO3反应 |
11.2009年7月27日,俄科学家用钙-48原子轰击锫-249原子,预期得到117号超重元素,下列关于117号元素叙述正确的是( )
| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |
16.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
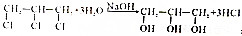 一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:
一个碳上连有两个烃基不隐定,容易失去一份水,试回答下列问题:

 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$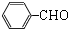 +2NaCl+2H2O
+2NaCl+2H2O .
.