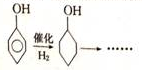
题目内容
4.某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.下列有关说法正确的是( )| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
分析 A.反应物的总能量大于生成物的总能量时,反应放热;气体分子数减少的反应为熵减的反应,根据△G=△H-T△S判断;
B.再加入二氧化碳,甲醇和二氧化碳的浓度都增大,但是二氧化碳增大幅度较大;
C.该反应为放热反应,温度升高,平衡向着逆向移动,平衡常数减小;
D.通入1mol CO2和3mol H2,反应中二者消耗的物质的量之比为1:3,则二者的转化率始终相等.
解答 解:A.该反应的焓变△H<0,正反应方向的气体分子数减少,气体分子数减少的反应为熵减的反应,即△S<0,则△G=△H-T△S<0,所以该反应在低温下能够自发进行,故A错误;
B.再加入一定量CO2,平衡向着正向移动,甲醇的物质的量增大,但是二氧化碳的物质的量的增大幅度大于甲醇,则n(CH3OH)/n(CO2)的比值减小,故B正确;
C.温度升高,该平衡向着逆向移动,生成物浓度减小,反应物浓度增大,则反应的平衡常数K减小,故C错误;
D.反应中二者的质量数之比为1:3,则二者反应消耗的物质的量之比为1:3,由于通入1mol CO2和3mol H2,所以无论是否达到平衡状态,二者的转化率始终相等,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学平衡常数、转化率的概念,能够正确判断反应能否自发进行,试题培养了学生的灵活应用能力.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
10.已知短周期元素的离子 aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:B>A>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:D ->C 2->B +>A 2+ | D. | 离子的还原性:D ->C 2- |
11.2009年7月27日,俄科学家用钙-48原子轰击锫-249原子,预期得到117号超重元素,下列关于117号元素叙述正确的是( )
| A. | 该合成过程是化学变化 | B. | 该元素在第七周期ⅤⅡA族 | ||
| C. | 该元素是非金属性比较强的元素 | D. | 该元素形成的氢化物比较稳定 |
9.已知NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 2gH2的分子数为NA | |
| B. | 标准状况下,22.4LH2O含有NA个水分子 | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 1mol/LMg(NO3)2溶液中含有NO3-的数目为2NA |
16.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
13.N2和H2在一定条件下反应的热化学方程式为N2(g)+3H2(g)?2NH2(g)△H=-92KJ/mol,已知H-H键的键能为436kJ/mol.N-H键的键能为391kJ/mol,则N=N键的键能是( )
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题: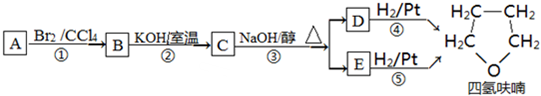
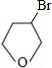 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$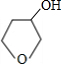 +NaBr.
+NaBr. ,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成
,根据提示的信息,模仿以下提示的流程图设计合成路线,以苯酚为主要原料合成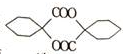 ,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)
,标明每一步的反应物及反应条件(有机物写结构简式,其它原料自选)