题目内容
11.从氧化还原角度分析,下列反应中水作氧化剂的是( )①Na和H2O ②NO2和H2O ③F2和H2O ④Na2O3和H2O.
| A. | ① | B. | ② | C. | ③ | D. | ④ |
分析 反应中水可为氧化剂、还原剂,也可既为氧化剂又为还原剂,从元素化合价变化的角度进行判断.
解答 解:①Na和H2O的反应中H2O为氧化剂;
②NO2和H2O的反应中H2O既不是氧化剂又不是还原剂;
③F2和H2O 的反应中H2O是还原剂;
④Na2O2和H2O的反应中H2O既不是氧化剂又不是还原剂,
故选A.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价变化的角度判断水在反应的中的作用即可解答该题.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
17.下列化合物中,既含有离子键又含有共价键的是( )
| A. | H2O2 | B. | Na2O | C. | CO2 | D. | NaOH |
2.用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的流程如图.
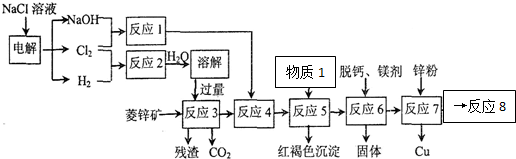
(1)电解饱和食盐水,H2在阴极生成
(2)在反应3前要将菱锌矿研磨,其目的是增大反应物的接触面积,加快反应速率,提高浸取率
(3)反应4的目的:将Fe2+氧化为Fe3+
(4)物质1最佳选用:C(填符号),调节pH至3.2-6.4(填范围),目的是将Fe3+完全转化为Fe(OH)3除去
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的抑制Zn2+(ZnCl2)的水解.

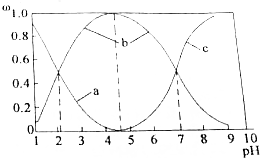
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.5 | 9.7 |
| Zn2+ | 6.4 | 8.0 |
(2)在反应3前要将菱锌矿研磨,其目的是增大反应物的接触面积,加快反应速率,提高浸取率
(3)反应4的目的:将Fe2+氧化为Fe3+
(4)物质1最佳选用:C(填符号),调节pH至3.2-6.4(填范围),目的是将Fe3+完全转化为Fe(OH)3除去
A.NH3•H2O B.NaOH C.ZnO
(5)反应8从溶液中获得ZnCl2,加热前需通入足量的HCl气体,目的抑制Zn2+(ZnCl2)的水解.
6.胶体区别与其他分散系的本质特征是( )
| A. | 能发生丁达尔现象 | |
| B. | 胶体粒子能通过滤纸空隙 | |
| C. | 胶体在一定条件下能稳定存在 | |
| D. | 胶体分散质粒子直径在1nm~100nm之间 |
16.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
1.现有四种有机物①C3H7Cl②C3H8O③C3H6O④C3H6O2,下列有关说法正确的是( )
| A. | ①、②、③、④均只有两种结构 | |
| B. | ①的同分异构体数目与④的相同 | |
| C. | ③一定是丙醛 | |
| D. | 若②与④能发生酯化反应,则生成的酯最多有2种 |
 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题: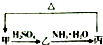 甲、乙、丙三种物质之间有如下转化关系(如图):
甲、乙、丙三种物质之间有如下转化关系(如图):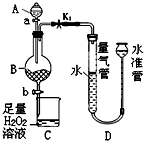 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).