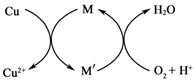
题目内容
17.砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:(1)画出砷的原子结构示意图
 .
.(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式2As2S3+5O2+6H2O=4H3AsO4+6S.该反应需要在加压下进行,原因是加压反应速率增大,而且平衡右移,可提高生产效率.
(3)已知:As(s)+$\frac{3}{2}$H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
2As(s)+$\frac{5}{2}$O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=2△H1-3△H2-△H3.
(4)298K时,将20mL 3x mol•L-1 Na3AsO3、20mL 3x mol•L-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-?AsO43-(aq)+2I-(aq)+H2O(l).溶液中c(AsO43-)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是ac(填标号).
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.c (AsO43-)/c (AsO33-)不再变化
d.c(I-)=y mol•L-1
②tm时,v正大于 v逆(填“大于”“小于”或“等于”).
③tm时v逆小于 tn时v逆(填“大于”“小于”或“等于”),理由是tm时AsO43-浓度更小,反应速率更慢.
④若平衡时溶液的pH=14,则该反应的平衡常数K为$\frac{4{y}^{3}}{(x-y)^{2}}$.
分析 (1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,据此写出原子结构示意图:
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,结合氧化还原反应电子守恒和原子守恒书写化学方程式,反应为气体体积减小的反应,增大压强提高反应速率,平衡正向进行,反应效率高;
(3)①As(s)+$\frac{3}{2}$H2(g)+2O2(g)=H3AsO4(s)△H1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
③2As(s)+$\frac{5}{2}$O2(g)=As2O5(s)△H3
盖斯定律计算得到反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H;
(4)①达到平衡时,正逆反应速率相等,各物质的浓度不变;
②反应从正反应开始进行,tm时反应继续正向进行;
③物质的浓度越大,反应速率越大;
④根据反应的离子方程式,计算平衡时各物种的浓度,可计算平衡常数.
解答 解:(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,原子结构示意图为 ,
,
故答案为: ;
;
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,
故答案为:2As2S3+5O2+6H2O=4H3AsO4+6S;加压反应速率增大,而且平衡右移,可提高生产效率;
(3)已知:①As(s)+$\frac{3}{2}$H2(g)+2O2(g)=H3AsO4(s)△H1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
③2As(s)+$\frac{5}{2}$O2(g)=As2O5(s)△H3
则利用盖斯定律将①×2-②×3-③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=2△H1-3△H2-△H3,
故答案为:2△H1-3△H2-△H3;
(4)①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;
c.c (AsO43-)/c (AsO33-)不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c (AsO43-)=y mol•L-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y mol•L-1,所以c(I-)=y mol•L-1时没有达到平衡状态,故d错误.
故答案为:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正 大于 v逆,故答案为:大于;
③tm时比tn时浓度更小,则逆反应速率更小,故答案为:小于;tm时AsO43-浓度更小,反应速率更慢;
④反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L×$\frac{20}{20+20+20}$=xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43-)为ymol/L,则反应生产的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,溶液中c(OH-)=1mol/L,则K=$\frac{y•(2y)2}{(x-y)•(x-y)×{1}^{2}}$=$\frac{4{y}^{3}}{(x-y)^{2}}$,
故答案为:$\frac{4{y}^{3}}{(x-y)^{2}}$.
点评 本题为2017年广西考题,综合考查热化学方程式、化学平衡的计算以及影响因素等知识,侧重考查学生的分析能力、计算能力,题中易错点为(4),注意把握图象的分析以及数据的处理,难度中等.

 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M能发生加聚反应、取代反应和氧化反应 | |
| B. | M的二氯代物有10种(不考虑立体异构) | |
| C. | N中所有碳原子在同一平面上 | |
| D. | 等物质的量的M、N分别完全燃烧,消耗O2的体积比为4:5 |
| A. | 60g丙醇中含有的共价键的数目为10NA | |
| B. | 在含有1molFeI2 的溶液中,通过足量的氯气,转移的电子数是3NA | |
| C. | 某溶液中Na2CO3和NaHCO3的浓度均为0.1mol/L,Na+离子总数为0.3NA | |
| D. | 50mL 12mol/L 盐酸与足量MnO2共热,转移的电子数为0.3NA |

| A. | 反应①的产物中含有水 | B. | 反应②中只有碳碳键形成 | ||
| C. | 汽油主要是C5~C11的烃类混合物 | D. | 图中a的名称是2-甲基丁烷 |
| A. | 0.1 mol 的11B中,含有0.6NA个中子 | |
| B. | pH=1的H3PO4溶液中,含有0.1NA个H+ | |
| C. | 2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 | |
| D. | 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键 |
| A. | 硅太阳能电池工作时,光能转化成电能 | |
| B. | 锂离子电池放电时,化学能转化成电能 | |
| C. | 电解质溶液导电时,电能转化成化学能 | |
| D. | 葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
| A. | 乙酸是一种重要的有机酸,常温下是具有刺激性气味的液体 | |
| B. | 乙酸的分子式为C2H4O2,与甲酸(HCOOH)互为同系物 | |
| C. | 乙酸不能被酸性高锰酸钾稀溶液氧化 | |
| D. | 乙酸官能团的结构式为-COOH |
| A. | 质量数为31的磷原子:3115P | B. | 氟原子的结构示意图: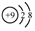 | ||
| C. | CaCl2的电子式: | D. | 明矾的化学式:Al2(SO4)3 |