题目内容
3.下列关于乙酸的说法中,错误的是( )| A. | 乙酸是一种重要的有机酸,常温下是具有刺激性气味的液体 | |
| B. | 乙酸的分子式为C2H4O2,与甲酸(HCOOH)互为同系物 | |
| C. | 乙酸不能被酸性高锰酸钾稀溶液氧化 | |
| D. | 乙酸官能团的结构式为-COOH |
分析 乙酸为具有刺激性气味的液体,分子式为C2H4O2,结构简式为CH3COOH,含有羧基,具有酸性,可发生中和、酯化反应,以此解答该题.
解答 解:A.乙酸为有机物,为液体,具有刺激性气味,故A正确;
B.分子式为C2H4O2,结构简式为CH3COOH,与甲酸(HCOOH)结构相似,分子式不同,互为同系物,故B正确;
C.乙酸含有羧基,不能被高锰酸钾氧化,故C正确;
D.CH3COOH含有的官能团为羧基,结构式为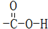 ,故D错误.
,故D错误.
故选D.
点评 本题综合考查乙酸的结构和性质,为高频考点,侧重考查学生的分析能力,有利于学生双基的夯实,难度不大,注意把握有机物的结构、性质,把握相关概念的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列关于有机化合物的说法不正确的是( )
| A. | 淀粉和纤纤维素互为同分异构体 | |
| B. | 油脂在碱性条件下的水解反应称为皂化反应 | |
| C. | 分子式为C5H10O2的有机物中能与NaHCO3溶液反应的有4种 | |
| D. | 在加热条件下,用新制的氢氧化铜悬浊液可鉴别乙醇和葡萄糖 |
20. 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
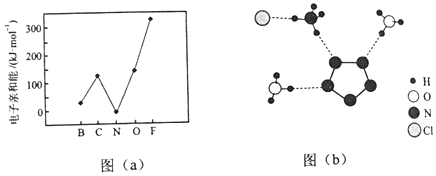
4.根据元素周期表和元素周期律,判断下列叙述不正确的是( )
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“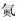 ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
15.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下.
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
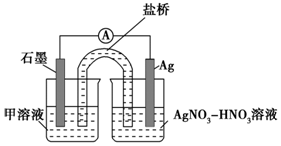
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
3.下列说法正确的是( )
| A. | 1 mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3 mol高级脂肪酸(盐) | |
| D. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 |
9.燃烧0.2mol某有机物,得到0.4mol CO2和 0.6mol H2O,由此可得出的结论是( )
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
 .
.
 .
.