题目内容
5.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:下列说法不正确的是( )
| A. | 反应①的产物中含有水 | B. | 反应②中只有碳碳键形成 | ||
| C. | 汽油主要是C5~C11的烃类混合物 | D. | 图中a的名称是2-甲基丁烷 |
分析 A.从质量守恒的角度判断,二氧化碳和氢气反应,生成物中应含有氢;
B.反应②生成烃类物质,含有C-C键、C-H键;
C.汽油所含烃类物质常温下为液态,易挥发;
D.图中a烃含有5个C,且有一个甲基.
解答 解:A.从质量守恒的角度判断,二氧化碳和氢气反应,反应为CO2+H2=CO+H2O,则产物中含有水,故A正确;
B.反应②生成烃类物质,含有C-C键、C-H键,故B错误;
C.汽油所含烃类物质常温下为液态,易挥发,主要是C5~C11的烃类混合物,故C正确;
D.图中a烃含有5个C,且有一个甲基,应为2-甲基丁烷,故D正确.
故选B.
点评 本题综合考查碳循环知识,为高频考点,侧重考查学生的分析能力,本题注意把握化学反应的特点,把握物质的组成以及有机物的结构和命名,难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
16.下列化学用语正确的是( )
| A. | Zn的电子排布式:1s22s22p63s23p64s2 | |
| B. | Fe2+的电子排布式:[Ar]3d6 | |
| C. | C的价电子轨道表示式: | |
| D. | HClO的电子式: |
17.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
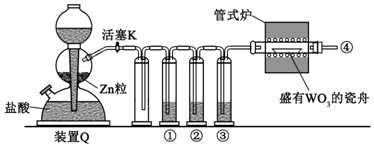

| A. | ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 | |
| B. | 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 | |
| C. | 结束反应时,先关闭活塞K,再停止加热 | |
| D. | 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
13.下列说法错误的是( )
| A. | 糖类化合物也可称为碳水化合物 | |
| B. | 维生素D可促进人体对钙的吸收 | |
| C. | 蛋白质是仅由碳、氢、氧元素组成的物质 | |
| D. | 硒是人体必需的微量元素,但不宜摄入过多 |
20. 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
10.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行.
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol-1
2C(s)+O2(g)=2CO(g)△H2=-220.9kJ•mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5kJ•mol-1.
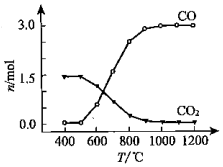
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H>0(填“>”“<”或“=”),判断依据:温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应.
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是饱和食盐水、氯化亚铁溶液.
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有TiO2、C.
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4.示意图如下:
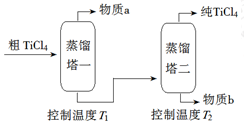
物质a是SiCl4,T2应控制在136℃左右.

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol-1
2C(s)+O2(g)=2CO(g)△H2=-220.9kJ•mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5kJ•mol-1.
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H>0(填“>”“<”或“=”),判断依据:温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应.

③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是饱和食盐水、氯化亚铁溶液.
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有TiO2、C.
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4.示意图如下:

物质a是SiCl4,T2应控制在136℃左右.
20.下列实验操作所得的现象及结论均正确的是( )
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlC13溶液加热蒸干 | 得到白色固体,成分为纯净的AlC13 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3己变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量C12 | 溶液变黄,则C12的氧化性强于Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
 .
.
 .
.