题目内容
8.NA代表阿伏伽德罗常数的值,下列说法正确的是( )| A. | 60g丙醇中含有的共价键的数目为10NA | |
| B. | 在含有1molFeI2 的溶液中,通过足量的氯气,转移的电子数是3NA | |
| C. | 某溶液中Na2CO3和NaHCO3的浓度均为0.1mol/L,Na+离子总数为0.3NA | |
| D. | 50mL 12mol/L 盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A、求出丙醇的物质的量,然后根据丙醇中含11条共价键来分析;
B、FeI2中的Fe2+和I-均能被氯气氧化;
C、溶液体积不明确;
D、二氧化锰只能与浓盐酸反应.
解答 解:A、60g丙醇的物质的量为1mol,而丙醇中含11条共价键,故1mol丙醇中含11NA条共价键,故A错误;
B、FeI2中的Fe2+和I-均能被氯气氧化,故1molFeI2失去3mol电子即3NA个,故B正确;
C、溶液体积不明确,故溶液中的钠离子总数无法计算,故C错误;
D、二氧化锰只能与浓盐酸反应,故盐酸不能反应完全,则转移的电子数小于0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
19.下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | Na2CO3•10H2O晶体久置后变成白色粉末 | Na2CO3•10H2O与空气中的CO2作用生成 NaHCO3 |
| B | 青铜(铜锡合金)在空气中久置表面会生成一层铜绿 | 发生电化学腐蚀,铜做负极 |
| C | 将过量SO2通入到KMnO4溶液中,溶液褪色 | SO2具有还原性,与 KMnO4发生氧化还原反应 |
| D | 向含有酚酞的 Na2CO3溶液中加入BaCl2固体, 溶液红色变浅 | Na2CO3溶液中的电离平衡发生移动 |
| A. | A | B. | B | C. | C | D. | D |
20.下列关于有机化合物的说法不正确的是( )
| A. | 淀粉和纤纤维素互为同分异构体 | |
| B. | 油脂在碱性条件下的水解反应称为皂化反应 | |
| C. | 分子式为C5H10O2的有机物中能与NaHCO3溶液反应的有4种 | |
| D. | 在加热条件下,用新制的氢氧化铜悬浊液可鉴别乙醇和葡萄糖 |
17.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
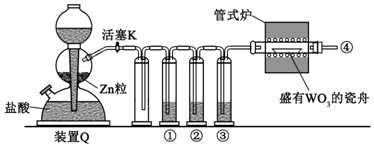

| A. | ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 | |
| B. | 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 | |
| C. | 结束反应时,先关闭活塞K,再停止加热 | |
| D. | 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
3.下列说法不正确的是( )
| A. | 1mol 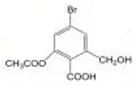 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol | |
| B. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别 | |
| C. | 乳酸薄荷醇酯(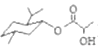 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| D. | 与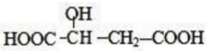 具有官能团种类及数目相同的同分异构体有2种 具有官能团种类及数目相同的同分异构体有2种 |
13.下列说法错误的是( )
| A. | 糖类化合物也可称为碳水化合物 | |
| B. | 维生素D可促进人体对钙的吸收 | |
| C. | 蛋白质是仅由碳、氢、氧元素组成的物质 | |
| D. | 硒是人体必需的微量元素,但不宜摄入过多 |
20. 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
3.下列说法正确的是( )
| A. | 1 mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3 mol高级脂肪酸(盐) | |
| D. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 |
 .
.