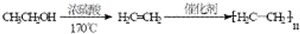题目内容
3.①25℃时,将a mol/L 的NaCN 溶液与0.01mol/L 的盐酸等体积混合,反应后测得溶液 pH=7,则(a) HCN 的电离常数Ka (用含ɑ的代数式表示)为(100a-1)×10-7 mol•L-1;
(b)下列关于该溶液的说法正确的是B.
A.此溶液有C(Na+)+C(H+)=C(OH-)+C(CN-)
B.此溶液有C(Na+)=C(HCN)+C(CN-)
C.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
②25℃时,H2SO3?HSO3-+H+的电离常数Ka=1×10-2 mol•L-1 ,则该温度下NaHSO3水解反应的平衡常数Kb=1.0×10-12mol•L-1,若向NaHSO3溶液中加入少量I2,则溶液中将$\frac{c({H}_{2}S{O}_{3})}{c(HS{{O}_{3}}^{-})}$增大(填“增大”、“减小”或“不变”)
分析 ①(a)反应后测得溶液pH=7,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka;
(b)A.根据电荷守恒分析;
B.根据物料守恒分析;
C.反应后测得溶液 pH=7,HCN的电离程度等于NaCN的水解程度;
②根据Ka=$\frac{c({H}^{+})×c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})}$,Kb=$\frac{c({H}_{2}S{O}_{3})×{K}_{w}}{c(HS{{O}_{3}}^{-})×c({H}^{+})}$,代入数据进行计算.
解答 解:①(a)由于反应后测得溶液pH=7,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),则c(CN-)=c(Na+)-c(Cl-)=($\frac{a}{2}$-0.005)mol/L,
由物料守恒可知,c(CN-)+c(HCN)=c(Na+),c(HCN)=c(Na+)-c(CN-)=0.005mol/L,
Ka﹦$\frac{c({H}^{+})•c(C{N}^{-})}{c(HCN)}$=$\frac{1{0}^{-7}×(\frac{a}{2}-0.005)}{0.005}$=(100a-1)×10-7 mol•L-1;
故答案为:(100a-1)×10-7 mol•L-1;
(b)A.25℃时,将a mol/L 的NaCN 溶液与0.01mol/L 的盐酸等体积混合,反应后测得溶液 pH=7,由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-),故A错误;
B.混合前,a mol/L 的NaCN 溶液中钠离子的浓度等于CN-的总浓度,由物料守恒可知,混合溶液有C(Na+)=C(HCN)+C(CN-),故B正确;
C.反应后测得溶液 pH=7,HCN的电离程度等于NaCN的水解程度,则混合溶液中水的电离程度等于该温度下纯水的电离程度,故C错误;
故答案为:B;
②已知Ka=$\frac{c({H}^{+})×c(HS{{O}_{3}}^{-})}{c({H}_{2}S{O}_{3})}$,水解方程式为:HSO3-+H2O?H2SO3+OH-,Kb=$\frac{c({H}_{2}S{O}_{3})×{K}_{w}}{c(HS{{O}_{3}}^{-})×c({H}^{+})}$=1.0×102×1.0×10-14=1.0×10-12,当加入少量I2时,碘把弱酸(亚硫酸)氧化成强酸(硫酸、氢碘酸),溶液酸性增强,[H+]增大,但是温度不变,Kb不变,则$\frac{c({H}_{2}S{O}_{3})}{c(HS{{O}_{3}}^{-})}$增大,
故答案为:1.0×10-12;增大.
点评 本题考查了酸碱混合的定性判断、溶液中守恒关系的应用、电离常数与水解常数的应用等知识,题目难度中等,明确酸碱混合的定性判断及溶液酸碱性与溶液pH的计算方法为解答关键,试题侧重考查学生的分析、理解能力.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 粒子半径的大小顺序:r(W)>r(X)>r(Z+)>r(Y3-) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | W的气态简单氢化物的热稳定性比X的强 | |
| D. | 工业上可用X的单质与W的氧化物反应制备W的单质 |
| A. | Z的氢化物是同主族简单氢化物中最稳定的 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y的最高价氧化物对应的水化物酸性后者强 |
| A. | 大量使用化肥和农药,能不断提高农作物产量 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
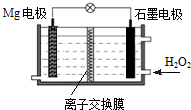 Mg-H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )
Mg-H2O2电池可用于无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如图.下列说法正确的是( )| A. | Mg电极是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 该电池的总反应为:Mg+H2O2═Mg(OH)2 | D. | 溶液中Cl-向正极移动 |
| 化学键 | H-Cl | Cl-Cl | H-H | C-H | C-Cl |
| 键能/(kJ•mol-1) | 431.4 | 242.1 | 435.9 | 413.0 | 338.9 |
(2)判断甲烷的氯代反应Cl2(g)+CH4(g)═CH3Cl(g)+HCl(g),是吸热反应还是放热反应?
(1)用碱式滴定管量取20.00mL待测液,将其移至锥形瓶中,再滴入酚酞;
(2)用0.1000mol/L标准盐酸滴定NaOH溶液,滴定时两眼应注视锥形瓶中溶液颜色变化直到滴定终点;
(3)以下操作中能导致所测定NaOH溶液浓度偏低的是(注意:错选、多选倒扣分)BC;
A.酸式滴定管未用标准溶液润洗
B.摇动锥形瓶时,有液滴飞溅出来
C.读取盐酸的体积时,滴定前平视读数,滴定后俯视读数
(4)某同学滴定时记录的数据如下:
| 实验编号 | 待测NaOH溶液的体积/mL | 滴定完成时,消耗盐酸的体积/mL |
| 1 | 20.00 | 22.40 |
| 2 | 20.00 | 22.42 |
| 3 | 20.00 | 22.38 |
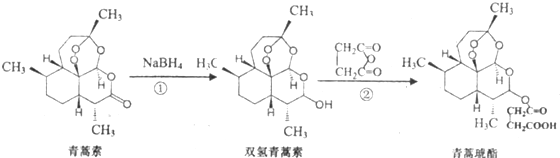
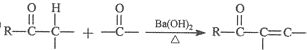
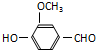 ,有关反应过程如下:
,有关反应过程如下: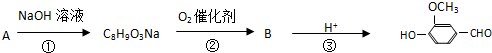
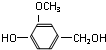 B
B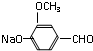 .
.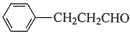 的合成路线流程图.(无机试剂任用,路线流程图示例如下:
的合成路线流程图.(无机试剂任用,路线流程图示例如下: