题目内容
7.节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨.甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2?CH3OH.请根据图示回答下列: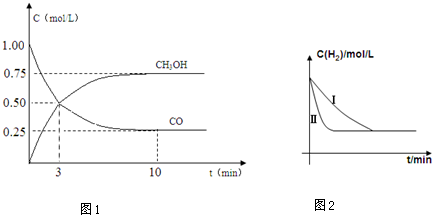
(1)关于该反应的下列说法中,正确的是C(填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,净测得CO和CH3OH(g)的浓度随时间变化如(图1)所示.从反应开始到平衡,CO的平均反应速率v(CO)=0.075mol/(L.min),
该反应的平衡常数K=$\frac{4}{3}$.
(3)恒容条件下,达到平衡后,下列措施中能使$\frac{n(C{H}_{3}OH)}{n(CO)}$增大的有C.
A.升高温度 B.充入He气 C.再冲入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍,则平衡时混合气体的平均摩尔质量=25.6g/mol.
(5)工业上用水煤气来合成有机燃料,例如:CO(g)+2H2(g)$\stackrel{一定条件}{?}$CH3OH(g)△H=-91kJ/mol某同学在不同实验条件下模拟化工生产进行实验,H2浓度随时间变化如图2:
①实验I比实验II达到平衡所用的时间长.(填“长”“短”或“相等”)
②实验III比实验I的温度要高,其它条件相同,请在图2中画出实验I和实验III中H2浓度随时间变化的示意图.
分析 (1)该反应为气体体积减小的反应,所以该反应△S<0,△H-T△S<0反应自发进行;
(2)由图可知,10min到达平衡,平衡时CO浓度为0.25mol/L,则△c(CO)=(1.00-0.25)mol/L=0.75mol/L,则平衡时c(CH3OH)=△c(CO)=0.75mol/L,平衡时c(H2)=3mol/L-2△c(CO)=1.5mol/L,
根据v=$\frac{△c}{△t}$计算v(CO),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
(3)使平衡体系中$\frac{n(C{H}_{3}OH)}{n(CO)}$增大,可以使平衡正向移动,注意不能增大CO或降低甲醇的量,也可能增大甲醇的量,使平衡逆向移动;
(4)同温同压下,气体的密度之比等于摩尔质量之比;
(5)①与实验Ⅰ比较,实验Ⅱ达到平衡时间长;
②正反应放热,升高温度平衡向逆反应方向移动,氨气的转化率减小.
解答 解:(1)该反应为气体体积减小的反应,所以该反应△S<0,△H-T△S<0反应自发进行,所以△H<0,故选:C;
(2)由图可知,10min到达平衡,平衡时CO浓度为0.25mol/L,则△c(CO)=(1.00-0.25)mol/L=0.75mol/L,则平衡时c(CH3OH)=△c(CO)=0.75mol/L,平衡时c(H2)=3mol/L-2△c(CO)=1.5mol/L,则:v(CO)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.75}{0.25×1.{5}^{2}}$=$\frac{4}{3}$,
故答案为:0.075mol/(L.min);$\frac{4}{3}$;
(3)A.正反应为放热反应,升高温度平衡逆向移动,$\frac{n(C{H}_{3}OH)}{n(CO)}$减小,故A错误;
B.充入He气体,恒温恒容下,各物质浓度不变,平衡不移动,则$\frac{n(C{H}_{3}OH)}{n(CO)}$不变,故B错误;
C.再冲入1molCO和3molH2,等效为增大压强,平衡正向移动,$\frac{n(C{H}_{3}OH)}{n(CO)}$增大,故C正确;
D.使用催化剂可以加快反应速率,不影响平衡移动,$\frac{n(C{H}_{3}OH)}{n(CO)}$不变,故D错误,
故选:C;
(4)开始通入1molCO、2molH2和1molCH3OH,平均摩尔质量=$\frac{1×28+2×2+1×32}{1+2+1}$g/mol=16g/mol,同温同压下,气体的密度之比等于摩尔质量之比,故平衡时混合气体的平均摩尔质量=1.6×16g/mol=25.6g/mol,
故答案为:25.6;
(5)①与实验Ⅰ比较,实验Ⅱ达到平衡时间长,故答案为:长;
②正反应放热,升高温度反应速率加快,平衡向逆反应方向移动,氢气的平浓度增大,图象 ,故答案为:
,故答案为: .
.
点评 本题考查较为综合,涉及反应速率的计算、平衡常数、化学反应速率的影响因素、化学平衡问题,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握化学平衡常数的应用以及平衡移动的影响因素,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | ① | B. | ①②④ | C. | ①③⑤ | D. | ①③④⑤ |
| 反应过程 | 化学方程式 | 不同温度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
(1)二甲醚碳基化反应的△H<0 (填“>”“<”“=”).
(2)若反应在恒温恒容下进行,下列可说明反应已经达到平衡状态的是BD.
A.2v(CH3COOCH3)=v(H2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中C2H5OH的体积分数保持不变
(3)总反应CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g)的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$,随温度的升高,总反应的K将减小 (填“增大”、“不变”或“减小”).
(4)在压强为1Mpa条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示.观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是随温度升高而增大,简要解释产生这种变化的原因该温度范围,反应Ⅰ转化率都很大,反应Ⅱ的转化率随温度升高而减小,所以乙酸甲酯的含量升高.
(5)将CH3OCH3(g)和CO(g)按物质的量之比1:1充入密闭容器中发生碳基化反应,在T K时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |
A.通入一定量的CO B.移出一定量的CH3OCH3C.加入合适的催化剂
②在图3中画出TK,CH3COOCH3(g)的体积分数随反应时间的变化曲线.

| A. | NaOH--Na2CO3--BaCl2--HCl | B. | NaOH--BaCl2--Na2CO3--HCl | ||
| C. | KOH--K2CO3--Ba(NO3)2--HNO3 | D. | KOH--Ba(NO3)2--K2CO3--HNO3 |
| A. | 冰熔化时只破坏范德华力而不破坏共价键 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 氢键存在于分子之间,也存在于分子之内 |

 .
. 与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗. (1)已知在25℃,101KPa时,1gH2(g)完全燃烧生成液态水时放出143KJ的热量,试写出表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1
(1)已知在25℃,101KPa时,1gH2(g)完全燃烧生成液态水时放出143KJ的热量,试写出表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(1)△H=-572kJ•mol-1