题目内容
17.你认为下列说法正确的是( )| A. | 冰熔化时只破坏范德华力而不破坏共价键 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 氢键存在于分子之间,也存在于分子之内 |
分析 A.水分子之间存在范德华力和氢键;
B.范德华力与相对分子质量和分子结构有关;
C.NH3与水分子之间存在氢键;
D.邻羟基苯甲醛分子(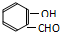 ) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子( 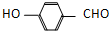 )之间存在氢键.
)之间存在氢键.
解答 解:A.水分子间存在氢键,冰熔化时破坏分子间作用力和氢键,故A错误;
B.范德华力与相对分子质量和分子结构有关,有机物同分异构体的分子式相同,相对分子质量相同,其支链越多,沸点越低,故B错误;
C.NH3与水分子之间存在氢键,使氨气易溶于水,所以NH3极易溶于水的原因为NH3是极性分子和氨气与水分子间存在氢键,故C错误;
D.邻羟基苯甲醛分子(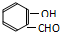 ) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子(
) 内的羟基与醛基之间即存在氢键,对羟基苯甲醛分子(  )之间存在氢键,所以氢键存在于分子之间,也存在于分子之内,故D正确.
)之间存在氢键,所以氢键存在于分子之间,也存在于分子之内,故D正确.
故选D.
点评 本题考查了氢键、分子间作用力,题目难度不大,注意把握氢键、范德华力对物质物理性质的影响,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
8.欲将CaCl2溶液中含有的盐酸除掉,应采用的最好方法是( )
| A. | 加生石灰,过滤 | B. | 加适量的AgNO3溶液 | ||
| C. | 加过量的Na2CO3溶液 | D. | 加CaCO3粉末,过滤 |
5.可以用来鉴别己烯、甲苯、乙醛、苯酚溶液的一组试剂是( )
| A. | 氯化铁溶液、高锰酸钾酸性溶液 | B. | 碳酸钠溶液、溴水 | ||
| C. | 新制的银氨溶液溶液、溴水 | D. | 新制氢氧化铜悬浊液、氯化铁溶液 |
6.将19.2g Cu溶于100mL浓度均为1mol•L-1的HNO3和H2SO4的混合溶液中,若产生的气体为NO,则产生的NO在标准状况下的体积为( )
| A. | 2.24 L | B. | 1.68 L | C. | 3.36 L | D. | 1.12 L |
4. 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.
(1)已知合成氨的反应是一个典型的可逆反应,在一个一定容积的密闭容器中加入1mol 氮气和3mol 氢气,在一定条件下发生反应合成氨气,当反应物转化率达10%时,测得放出的热量为9.24kJ,请写出该条件下合成氨反应的热化学方式: N2(g)+3H2( g)═2NH3(g)△H=-92.4 kJ•mol-1 .
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0
通过下列哪种措施可提高CO的吸收效率A(填字母)
A.高压 B.高温 C.把[Cu(NH3)3]CH3COO•CO分离出去 D.增大CO浓度
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0
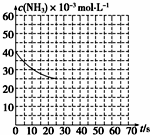
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其他条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①你认为该溶液呈碱(填“酸”、“中”或“碱”性),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(OH-)>c(H+)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.(1)已知合成氨的反应是一个典型的可逆反应,在一个一定容积的密闭容器中加入1mol 氮气和3mol 氢气,在一定条件下发生反应合成氨气,当反应物转化率达10%时,测得放出的热量为9.24kJ,请写出该条件下合成氨反应的热化学方式: N2(g)+3H2( g)═2NH3(g)△H=-92.4 kJ•mol-1 .
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0
通过下列哪种措施可提高CO的吸收效率A(填字母)
A.高压 B.高温 C.把[Cu(NH3)3]CH3COO•CO分离出去 D.增大CO浓度
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0
某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其他条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 | 1.77×10-5 |
| Ka2=5.61×10-11 |
①你认为该溶液呈碱(填“酸”、“中”或“碱”性),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(OH-)>c(H+)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
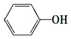 苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的
苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的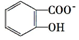
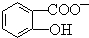 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.