题目内容
下列反应的离子方程式正确的是( )
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、氯化钡和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.原子个数不守恒;
B.次氯酸为弱电解质,保留化学式;
C.不符合反应的客观事实;
D.氯化钡和稀硫酸反应生成硫酸钡和盐酸.
B.次氯酸为弱电解质,保留化学式;
C.不符合反应的客观事实;
D.氯化钡和稀硫酸反应生成硫酸钡和盐酸.
解答:
解:A.钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.氯气与水反应,离子方程式:Cl2+H2O=H++Cl-+HClO,故B错误;
C.铁与稀盐酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故C错误;
D.氯化钡和稀硫酸反应,离子方程式为:Ba2++SO42-=BaSO4↓,故D正确;
故选D.
B.氯气与水反应,离子方程式:Cl2+H2O=H++Cl-+HClO,故B错误;
C.铁与稀盐酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故C错误;
D.氯化钡和稀硫酸反应,离子方程式为:Ba2++SO42-=BaSO4↓,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意化学式拆分和反应的客观事实.

练习册系列答案
相关题目
已知H++OH-═H2O生成1mol H2O放出热量57.3kJ,下列反应中能放出57.3kJ热量的是( )
| A、1mol稀H2SO4与足量NaOH溶液反应 |
| B、稀盐酸与氨水反应生成1 mol H2O |
| C、稀NaOH与95%浓硫酸反应生成1 mol水 |
| D、稀盐酸与稀Ba(OH)2溶液反应生成1 mol水 |
下列关于科学家及其提出学说与贡献的叙述不对应的是( )
| A、道尔顿提出原子学说 |
| B、汤姆生发现电子,并提出原子结构轨道模型 |
| C、舍勒发现了氯气 |
| D、卢瑟福根据α粒子散射现象,提出了带核的原子结构模型 |
下列各组离子在溶液中因氧化还原反应而不能大量共存的是( )
| A、Fe2+、Cl-、NO3-、K+ |
| B、Fe2+、H+、NO3-、SO42- |
| C、Al3+、Mg2+、NO3-、OH- |
| D、Fe2+、Cu2+、Cl-、NO3- |
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的热稳定性c>d,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |
能在水溶液中大量共存的一组离子是( )
| A、K+、H+、NO3-、SiO32- |
| B、H+、NH4+、Al3+、SO42- |
| C、Fe2+、H+、ClO-、SO42- |
| D、Al3+、Mg2+、SO42-、CO32- |
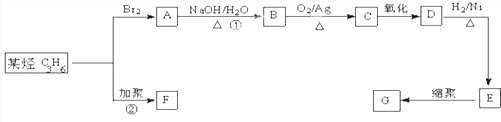
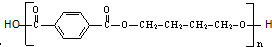 )是一种重要的工程塑料.
)是一种重要的工程塑料.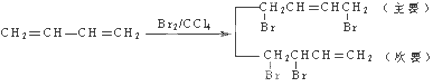
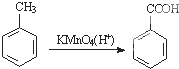
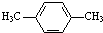 为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH
为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH 合成PBT的反应流程图为:
合成PBT的反应流程图为: