题目内容
已知:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成 4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变).请计算:
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量.
| ||
(1)反应耗用MnO2的质量
(2)被氧化的HCl物质的量.
考点:化学方程式的有关计算
专题:计算题
分析:利用氯气在标况下的体积来计算其物质的量,然后利用化学方程式计算MnO2的物质的量、参加反应的HCl的物质的量,根据m=nM计算二氧化锰的质量,由方程式可知HCl有一半被氧化.
解答:
解:氯气的物质的量为
=0.2mol,
设耗用二氧化锰的物质的量为xmol,参加反应的HCl的物质的量为ymol,则:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
1 4 1
x y 0.2mol
解得x=
=0.2mol,y=
=0.8mol,
(1)反应耗用MnO2的质量为0.2mol×87g/mol=17.4g,
答:反应耗用MnO2的质量为17.4g;
(2)被氧化的HCl物质的量为0.8mol×
=0.4mol,
搭:被氧化的HCl物质的量为0.4mol.
| 44.8L |
| 22.4L/mol |
设耗用二氧化锰的物质的量为xmol,参加反应的HCl的物质的量为ymol,则:
MnO2+4HCl(浓)
| ||
1 4 1
x y 0.2mol
解得x=
| 1×0.2mol |
| 1 |
| 4×0.2mol |
| 1 |
(1)反应耗用MnO2的质量为0.2mol×87g/mol=17.4g,
答:反应耗用MnO2的质量为17.4g;
(2)被氧化的HCl物质的量为0.8mol×
| 1 |
| 2 |
搭:被氧化的HCl物质的量为0.4mol.
点评:本题考查根据化学方程式的计算、氧化还原反应计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列说法正确的是( )
| A、等质量的铝分别投入过量的稀盐酸和NaOH溶液中,反应生成的气体在相同条件下体积相等 |
| B、金属单质与水反应都生成对应的碱和氢气 |
| C、活泼的金属或较活泼的金属都能与酸反应,但不能与碱反应 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动顺序表中钠后面的金属 |
已知I-、Fe2+、SO2和H2O2均有还原性,在酸性溶液中还原能力的强弱顺序为:H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、H2O2+H2SO4═SO2↑+O2↑+2H2O |
| C、I2+SO2+2H2O═H2SO4+2HI |
| D、2Fe3+2I-═2Fe2++I2 |
已知H++OH-═H2O生成1mol H2O放出热量57.3kJ,下列反应中能放出57.3kJ热量的是( )
| A、1mol稀H2SO4与足量NaOH溶液反应 |
| B、稀盐酸与氨水反应生成1 mol H2O |
| C、稀NaOH与95%浓硫酸反应生成1 mol水 |
| D、稀盐酸与稀Ba(OH)2溶液反应生成1 mol水 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、14g乙烯和丁烯的混合物中含有的原子总数为3NA个 |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
C、1mol苯乙烯( 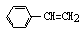 )中含有的C=C数为4NA )中含有的C=C数为4NA |
| D、7g CnH2n中含有的氢原子数目为2NA |
下列关于科学家及其提出学说与贡献的叙述不对应的是( )
| A、道尔顿提出原子学说 |
| B、汤姆生发现电子,并提出原子结构轨道模型 |
| C、舍勒发现了氯气 |
| D、卢瑟福根据α粒子散射现象,提出了带核的原子结构模型 |
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的热稳定性c>d,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |