题目内容
20.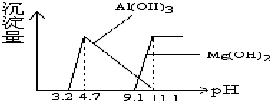 根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:下列有关说法正确的是( )
| A. | Al(OH)3 和Mg(OH)2在水溶液中的电离过程完全相同 | |
| B. | 若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 | |
| C. | 当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) | |
| D. | 等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
分析 A.氢氧化铝为两性氢氧化物,在溶液中存在酸式和碱式电离;
B.根据图象可知,pH小于4.7时镁离子还没有开始沉淀;
C.溶液中还存在过量的氢氧化钠;
D.氨水为弱碱,不会溶解氢氧化铝.
解答 解:A.Al(OH)3 为类型氢氧化物,在溶液中能够电离出氢离子,还能够电离出氢氧根离子,而Mg(OH)2在水溶液中只能电离出氢氧根离子,所以二者的电离过程不完全相同,故A错误;
B.由图象可知,pH≥9.1时开始生成氢氧化镁沉淀,所以pH<4.7时,n(Mg2+)几乎不变化,故B正确;
C.当pH>11.1时,溶液中含有NaCl、NaAlO2(Na[Al(OH)4])及过量的NaOH,故C错误;
D.等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,由于氨水为弱碱,不会溶解氢氧化铝,所以氨水的pH与沉淀量关系与上图不同,故D错误;
故选B.
点评 本题考查了难溶物溶解平衡及其影响,题目难度中等,明确溶解平衡及其影响因素为解答关键,注意氨水为弱碱,不会溶解氢氧化铝,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.25℃时,0.1mol/L稀醋酸加水稀释后,下列变化量随着水量的增多而降低的是( )
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
15.下列图示与对应的叙述相符的是( )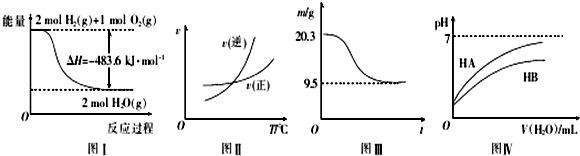

| A. | 图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ.mol-1 | |
| B. | 图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应 | |
| C. | 图Ⅲ表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
5.印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
(1)常温下,物质的量浓度相等的①NaClO2、②NaF、③NaCN、④Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:前者大(填“前者大”“相等”或“后者大”).
(2)Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时的S2-的浓度为6.3×10-13.
已知Ksp(FeS)=6.3×10-18(mol•L-1)2,Ksp(CuS)=6×10-36(mol•L-1)2Ksp(PbS)=2.4×10-28(mol•L-1)2.
| 弱酸 | HClO2 | HF | HCN | H2S |
| Ka | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8K2=1.1×10-12 |
(2)Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是CuS;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时的S2-的浓度为6.3×10-13.
已知Ksp(FeS)=6.3×10-18(mol•L-1)2,Ksp(CuS)=6×10-36(mol•L-1)2Ksp(PbS)=2.4×10-28(mol•L-1)2.
10.元素R在第五周期,最外层有3个电子,通过画其原子结构示意图可知其原子序数为( )
| A. | 39 | B. | 43 | C. | 49 | D. | 63 |
 C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )