题目内容
已知:C(s)+H2O(g)===CO (g) +H2 (g) ΔH=a kJ·mol-1
2C(s)+ O2(g)===2CO (g) ΔH= - 220 kJ·mol-1
H-H、O==O和O- H键的键能分别为436、496和462 kJ·mol-1,则 a 为
H键的键能分别为436、496和462 kJ·mol-1,则 a 为
A.-332 B.+130 C.+350 D.-118
练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
2. pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示.下列说法正确的是( )| A. | A、B两酸溶液的物质的量浓度一定相等 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | a=5时,A是强酸,B是弱酸 | |
| D. | 若a小于5,则A、B都是弱酸,且A的酸性弱于B |
4.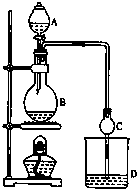 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用:催化剂、吸水剂,请用同位素18O示踪法确定该反应原理,写出能表示18O在反应前后位置变化的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、和水,应先加入无水氯化钙,分离出乙醇,再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂、吸水剂,请用同位素18O示踪法确定该反应原理,写出能表示18O在反应前后位置变化的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、和水,应先加入无水氯化钙,分离出乙醇,再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
5. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
实验步骤如下:
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:碎瓷片(按着加入的先后顺序写出名称),乙醇过量的目的是:提高乙酸的转化率;
(2)该反应的平衡常数表达式K=$\frac{[C{H}_{3}COOC{H}_{2}C{H}_{3}][{H}_{2}O]}{[CH{\;}_{3}COOH][C{H}_{{\;}_{3}}C{H}_{2}OH]}$;
(3)试管Ⅱ中所盛试剂为饱和碳酸钠溶液,欲将其物质分离使用的仪器为分液漏斗,在充分振荡的过程中,发生的反应为2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L;
②分析实验A、C(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会低(“较高”或“偏低”).
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.| 物质 | 沸点/°C | 密度/g?cm-3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 异戊醇 | 131 | 0.8123 |
| 乙酸异戊酯 | 142 | 0.8670 |
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:碎瓷片(按着加入的先后顺序写出名称),乙醇过量的目的是:提高乙酸的转化率;
(2)该反应的平衡常数表达式K=$\frac{[C{H}_{3}COOC{H}_{2}C{H}_{3}][{H}_{2}O]}{[CH{\;}_{3}COOH][C{H}_{{\;}_{3}}C{H}_{2}OH]}$;
(3)试管Ⅱ中所盛试剂为饱和碳酸钠溶液,欲将其物质分离使用的仪器为分液漏斗,在充分振荡的过程中,发生的反应为2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A、C(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收酯化反应中生成的水,降低了生成物浓度使平衡向生成乙酸乙酯的方向移动;
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会低(“较高”或“偏低”).


 N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g)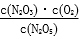 为
为 Z(g)+W(s);△H>0,下列叙述正确的是
Z(g)+W(s);△H>0,下列叙述正确的是 定条件下,对于A2(g)+3B2(g)
定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的
2AB3(g)反应来说,下列所表示的化学反应速率中最大的 是
是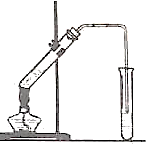 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.