题目内容
20.铝可以制成多种建筑型材,铝在空气中能够稳定存在的原因是( )| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
分析 铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止了铝进一步氧化,使铝在空气中能够稳定存在.
解答 解:A.金属铝的密度小,不是金属铝在空气中能够稳定存在的原因,故A错误;
B.铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,这是铝在空气中能够稳定存在的原因,故B正确;
C.常温下,铝在空气中与氧气反应生成氧化铝,故C错误;
D.铝是一种比较活泼的金属,属于亲氧元素,极易和空气中氧气反应生成氧化铝,故D错误;
故选B.
点评 本题考查铝的性质,为高频考点,明确铝是亲氧元素是解本题关键,注意Al在空气中加热现象,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
10.邻苯二甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约0.97g/cm3,常用作聚氯乙烯等树脂的增塑剂.工业上生产原理和工艺流程如下:
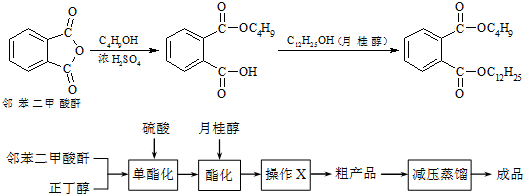
有关物质的物理性质见下表:
某实验小组的同学模拟工业生产的工艺流程,用如图所示装置制取少量邻苯二甲酸丁基月桂酯,图中夹持和加热装置已略去.主要操作步骤如下: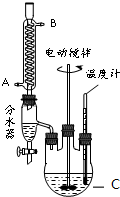
②向三颈烧瓶内加入30g 邻苯二甲酸酐、16g 正丁醇以及少量浓硫酸.
②搅拌,升温至105℃,持续搅拌反应1小时.
③冷却至室温,加入40g 月桂醇,升温至160℃,搅拌、保温至反应结束.
④冷却至室温,将反应混合物倒出.
⑤通过工艺流程中的操作X,得到粗产品.
请回答下列问题:
(1)仪器C的名称三颈烧瓶.冷凝管中冷水应从A进.
(2)步骤③中判断反应已结束的方法是分水器中的水不再增加.
(3)步骤⑤中操作X可除去少量未反应的邻苯二甲酸酐及正丁醇,操作X包括先用饱和碳酸钠洗涤、分液,再用蒸馏水洗涤、分液(洗涤、分液).
(4)工艺流程中减压蒸馏的目的是降低沸点,防止高温下发生副反应,致使产品不纯.
(5)实验结果表明步骤②、③产率都比较高,原因是生成的水蒸出冷凝成液态后通过分水器从体系中分离出去,促进反应.

有关物质的物理性质见下表:
| 化合物 | 溶解性 | 熔点 | 沸点 |
| 邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
| 正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
| 月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
| 邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |

②向三颈烧瓶内加入30g 邻苯二甲酸酐、16g 正丁醇以及少量浓硫酸.
②搅拌,升温至105℃,持续搅拌反应1小时.
③冷却至室温,加入40g 月桂醇,升温至160℃,搅拌、保温至反应结束.
④冷却至室温,将反应混合物倒出.
⑤通过工艺流程中的操作X,得到粗产品.
请回答下列问题:
(1)仪器C的名称三颈烧瓶.冷凝管中冷水应从A进.
(2)步骤③中判断反应已结束的方法是分水器中的水不再增加.
(3)步骤⑤中操作X可除去少量未反应的邻苯二甲酸酐及正丁醇,操作X包括先用饱和碳酸钠洗涤、分液,再用蒸馏水洗涤、分液(洗涤、分液).
(4)工艺流程中减压蒸馏的目的是降低沸点,防止高温下发生副反应,致使产品不纯.
(5)实验结果表明步骤②、③产率都比较高,原因是生成的水蒸出冷凝成液态后通过分水器从体系中分离出去,促进反应.
5.下列各项操作中,发生“先产生沉淀,后沉淀又溶解”现象的是( )
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ②向AlCl3溶液中通入过量的NH3
③向Ca(OH)2溶液中逐渐通入过量的CO2 ④向NaAlO2溶液中逐滴加入过量的盐酸.
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸 ②向AlCl3溶液中通入过量的NH3
③向Ca(OH)2溶液中逐渐通入过量的CO2 ④向NaAlO2溶液中逐滴加入过量的盐酸.
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
9.实验室用软锰矿(MnO2)与浓盐酸加热制氯气,下列说法正确的是( )
| A. | 盛浓盐酸的分液漏斗可用长颈漏斗代替 | |
| B. | 可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 | |
| C. | 用饱和食盐水吸收尾气 | |
| D. | 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
 室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)
室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5) .
. 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答: