题目内容
10.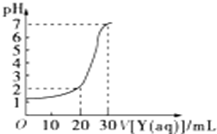 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
分析 设HCl的浓度为x,NaOH的浓度为y,
由图可知,NaOH加入20mL时pH=2,可知酸过量,则$\frac{0.01×x-0.02×y}{0.03}$=0.01;
NaOH加入30mL时pH=7,则0.01×x=0.03×y,以此来解答.
解答 解:设HCl的浓度为x,NaOH的浓度为y,
由图可知,NaOH加入20mL时pH=2,可知酸过量,则$\frac{0.01×x-0.02×y}{0.03}$=0.01;
NaOH加入30mL时pH=7,则0.01×x=0.03×y,
联立$\frac{0.01×x-0.02×y}{0.03}$=0.01、0.01×x=0.03×y,
解得x=0.09mol/L,y=0.03mol/L,
故选C.
点评 本题考查酸碱混合的计算,为高频考点,把握图中pH及酸碱混合时过量判断为解答的关键,侧重分析与计算能力的考查,注意pH的计算方法,题目难度不大.

练习册系列答案
相关题目
19.下列属于混合物的是( )
| A. | 硅酸钠 | B. | 铜 | C. | 氢氧化铁胶体 | D. | 二氧化碳 |
17.恒温下,在容积为2L的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:
I2(g)+H2(g)═2HI(g)△H=-QkJ•mol-1,实验时有关数据如表:
下列判断正确的是( )
I2(g)+H2(g)═2HI(g)△H=-QkJ•mol-1,实验时有关数据如表:
| 容器编号 | 起始物质的量/mol | 4分钟后平衡时的物质的量/mol | 平衡时放出的热量/kJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4 mol•L-1•min-1 | |
| B. | 平衡时,放出的热量为:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
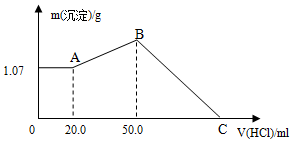 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答: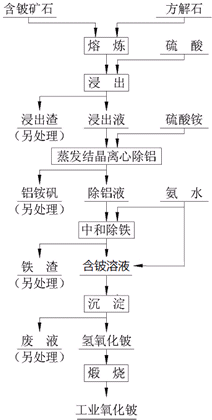 硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.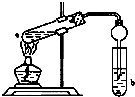 如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL的乙醇,边摇边缓慢加入2mL浓硫酸,再加入2mL无水乙酸,用玻玻棒充分搅拌后将试管固定在铁架台上,在试管b中加入适量饱和碳酸钠溶液.连接好装置,用酒精灯对试管加热,当观察到试管b中有明显现象时停止实验.