题目内容
3.下列关于Na2CO3和NaHCO3性质的说法错误的是( )| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 | |
| C. | 相同温度时,在水中的溶解性:NaHCO3<Na2CO3 | |
| D. | 等物质的量浓度溶液的碱性:NaHCO3<Na2CO3 |
分析 NaHCO3与Na2CO3相比较,NaHCO3不稳定,加热易分解,常温时,Na2CO3溶解度较大,与盐酸反应时,NaHCO3反应剧烈,在水中水解程度Na2CO3大,以此解答.
解答 解:A.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热稳定,所以热稳定性:NaHCO3<Na2CO3,故A正确;
B.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故B错误;
C.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故C正确;
D.在水中水解程度Na2CO3大,所以等物质的量浓度溶液,碱性较强的为Na2CO3,则pH为Na2CO3>NaHCO3,故D正确.
故选B.
点评 本题考查Na2CO3和NaHCO3性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握Na2CO3和NaHCO3性质的异同,注重基础知识的积累.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
11.下列实验操作或所记录的数据合理的是( )
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 配制500ml 0.1mol/L的NaOH溶液时,应用托盘天平称取2.00g NaOH固体 | |
| D. | 氢氟酸可保存在棕色玻璃瓶中 |
18.在由Fe、FeO和Fe2O3组成的混合物中加入100ml 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中滴入KSCN溶液无明显变化,则下列判断正确的是( )
| A. | 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe3+与的物质的量之比为1:3 | |
| C. | 混合物里FeO的物质的量无法确定,但Fe和Fe2O3的物质的量多 | |
| D. | 混合物里Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
8.下列试剂保存正确的是( )
| A. | 氯水保存在棕色细口瓶中 | B. | NaOH保存在具有玻璃塞的细口瓶中 | ||
| C. | 金属钠保存在CCl4中 | D. | 氢氟酸保存在玻璃塞的细口瓶中 |
15.下列说法正确的是( )
| A. | 某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- | |
| B. | 某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- | |
| C. | 某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ | |
| D. | 某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
12.下列各组离子,在水溶液中能大量共存的是( )
| A. | Na+、Ag+、Cl- | B. | Ba2+、H+、CO32- | C. | K+、Al3+、OH- | D. | Na+、Cl-、NO3- |

 )与新制氢氧化铜反应的化学方程式C6H5CHO+NaOH+2Cu(OH)2$\stackrel{水浴}{→}$C6H5COONa+Cu2O↓+3H2O
)与新制氢氧化铜反应的化学方程式C6H5CHO+NaOH+2Cu(OH)2$\stackrel{水浴}{→}$C6H5COONa+Cu2O↓+3H2O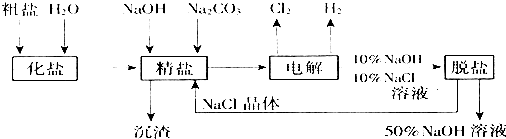
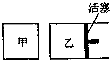 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,