题目内容
2.下列关于铵盐的表述正确的是( )| A. | NH4Cl和NaCl的固体混合物可用升华法分离 | |
| B. | 所有铵盐都易溶于水,所有铵盐中的氮均呈-3价 | |
| C. | 硝铵中不含铵根离子 | |
| D. | 铵态氮肥不能与碱性物质如草木灰混合施用 |
分析 A、氯化铵受热分解为氨气和氯化氢,但是氯化钠受热不分解;
B、铵盐都易溶于水,不是所有铵盐中的氮均呈-3价;
C、硝铵的化学名称叫硝酸铵,中含铵根离子;
D、铵态氮肥水解呈酸性,与水解呈碱性的物质不能混合使用;
解答 解:A、氯化铵受热分解为氨气和氯化氢,但是氯化钠受热不分解,NH4Cl和NaCl的固体混合物可用加热法分离,不是升华法,故A错误;
B、铵盐都易溶于水,不是所有铵盐中的氮均呈-3价,其中硝酸根离子中氮元素是+5价,故B错误;
C、硝铵的化学名称叫硝酸铵,中含铵根离子,故C错误;
D、铵态氮肥水解呈酸性,与水解呈碱性的物质不能混合使用,故D正确;
故选D.
点评 本题考查氨气的性质,为元素化合价知识中高频考点,注意把握铵盐的性质以及实验室制备氨气的特点,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
12.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )


| A. | 和金属钠作用时,键①断裂 | |
| B. | 乙醇燃烧时所有键断裂 | |
| C. | 和乙酸、浓硫酸共热制乙酸乙酯时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
13.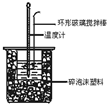 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )| A. | 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
10.图是实验室制取无水氯化镁的装置图,下列有关表述正确的是( )


| A. | 尾气吸收可以用浓硫酸作为吸收剂进行吸收 | |
| B. | 装置A中圆底烧瓶中可以换成固体MnO2 | |
| C. | 如果直接加热MgCl2•6H2O不能得到无水氯化镁,将可能得到MgO | |
| D. | 金属镁在空气中燃烧,剧烈反应生成氧化镁,如果金属镁燃烧发生火灾,要立即用二氧化碳灭火器进行灭火 |
7.在定温、定容条件下,不能标志H2(g)+I2(g)?2HI (g)达平衡的是( )
| A. | 单位时间内消耗amol H2,同时消耗 2amol HI | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器内H2、I2不再减少,HI不再增加 | |
| D. | 单位时间内每生成amol HI,同时a NA个HI分子分解 |
14.1mol某烃完全燃烧后,生成二氧化碳的体积为89.6L(标准状况),此气态烃在一定条件下能与氢气加成,反应时它与氢气在同温同压下的体积比为1:2,则此烃的结构简式为( )
| A. | CH3-CH═CH2 | B. | CH3-CH2-CH═CH2 | C. |  | D. | CH2═CH-CH═CH2 |
12.反应3ClO-+2Fe3++10OH-═2FeO42-+5H2O+3Cl-,下列有关该反应的说法中正确的是( )
| A. | ClO-作还原剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |