题目内容
13.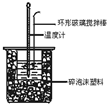 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )| A. | 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 | |
| C. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| D. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
分析 A.根据中和热的含义来判断;
B.为了保证实验准确,采用的酸碱中,往往保证一方过量;
C.酸碱混合时要迅速,并且不能搅拌,防止热量的散失;
D.根据中和热测定实验成败的关键是做好保温工作来回答.
解答 解:A.中和热的含义是稀的强酸和强碱溶液反应生成1mol水的过程中所放出的热量,用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,和用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行求出的中和热数值相同,故A正确;
B.在中和热的测定过程中,为了保证结果实验准确,采用的酸碱中,往往保证一方过量,让另一方充分反应,故B正确;
C.在中和热的测定过程中,酸碱混合时要迅速,防止热量的散失,保证放出的热量都体现在温度计温度的升高上,故C错误;
D.中和热测定实验成败的关键是做好保温工作,实验中,大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失,故D正确.
故选C.
点评 本题考查学生中和热的测定实验知识,为高频考点,侧重于学生的分析、实验能力的考查,注意中和热的含义是稀的强酸和强碱溶液反应生成1mol水的过程中所放出的热量,是一个定值,属于教材知识的考查,较简单.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
8.糖是人们日常生活中不可缺少的一类重要物质,下列有关糖类物质的叙述中,正确的是( )
| A. | 葡萄糖在酒化酶作用下水解生成乙醇和二氧化碳 | |
| B. | 淀粉、纤维素都是天然有机高分子化合物,分子式都写成(C6H10O5)n,二者互为同分异构体 | |
| C. | 蔗糖与麦芽糖互为同分异构体 | |
| D. | 蔗糖、麦芽糖、淀粉和纤维素都能水解且水解的最终产物都是葡萄糖 |
18.如表实验操作、现象和结论均正确的是选项实验操作现象结论( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
| C | KNO3和KOH混合溶液中加入铝粉 并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加 Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
5.在浓盐酸中HNO2与SnCl2反应的离子方程式为3SnCl2+12Cl-+2HNO2+6H+═N2+3SnClxy-+4H2O.关于该反应的说法都正确的是( )
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8g N2,还原剂失去的电子为0.6mol;④x为4,y为2;⑤SnClxy-是氧化产物.
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8g N2,还原剂失去的电子为0.6mol;④x为4,y为2;⑤SnClxy-是氧化产物.
| A. | ①③⑤ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
2.下列关于铵盐的表述正确的是( )
| A. | NH4Cl和NaCl的固体混合物可用升华法分离 | |
| B. | 所有铵盐都易溶于水,所有铵盐中的氮均呈-3价 | |
| C. | 硝铵中不含铵根离子 | |
| D. | 铵态氮肥不能与碱性物质如草木灰混合施用 |
 ;
;