题目内容
7.在定温、定容条件下,不能标志H2(g)+I2(g)?2HI (g)达平衡的是( )| A. | 单位时间内消耗amol H2,同时消耗 2amol HI | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器内H2、I2不再减少,HI不再增加 | |
| D. | 单位时间内每生成amol HI,同时a NA个HI分子分解 |
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,注意该反应是反应前后气体体积不变的化学反应,压强对该反应无影响,据此进行判断.
解答 解:A、单位时间内消耗amolH2同时生成2amolHI,且同时又消耗2amolHI,所以碘化氢的正逆反应速率相等,达到平衡状态,故A不选;
B、该反应是反应前后气体体积不变的化学反应,所以无论反应是否达到平衡状态混合气体的压强始终恒定不变,故B选;
C、反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,所以容器内H2、I2不再减少,HI不再增加,该反应达到平衡状态,故C不选;
D、单位时间内每生成amolHI,同时aNA个HI分子分解,反应方向相反且速率相等,达到平衡状态,故D不选;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意压强对反应前后气体体积不变的化学平衡无影响,只影响其反应速率.

练习册系列答案
相关题目
17. 己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )
己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )
 己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )
己烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取1 mol己烯雌酚进行4个实验.( )| A. | ①中生成7molH2O | B. | ②中无CO2生成 | ||
| C. | ③中最多消耗3molBr2 | D. | ④中发生消去反应 |
18.如表实验操作、现象和结论均正确的是选项实验操作现象结论( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
| C | KNO3和KOH混合溶液中加入铝粉 并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加 Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
15.除去SiO2中混有的少量生石灰和石灰石,有如下操作:( )
①加水溶解 ②加水煮沸 ③过滤 ④加稀HCl.
①加水溶解 ②加水煮沸 ③过滤 ④加稀HCl.
| A. | ①③ | B. | ④③ | C. | ⑤③ | D. | ②③ |
2.下列关于铵盐的表述正确的是( )
| A. | NH4Cl和NaCl的固体混合物可用升华法分离 | |
| B. | 所有铵盐都易溶于水,所有铵盐中的氮均呈-3价 | |
| C. | 硝铵中不含铵根离子 | |
| D. | 铵态氮肥不能与碱性物质如草木灰混合施用 |
16. 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
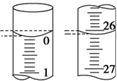
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
依据上表数据计算该H2C2O4溶液的物质的量浓度为0.2610mol/L(保留4位有效数字).
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:(1)该滴定实验应选用酸(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是高锰酸钾溶液具有强氧化性能氧化橡胶管.
(2)写出酸性高锰酸钾与草酸反应的离子方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(3)滴定终点的现象为滴入最后一滴高锰酸钾,锥形瓶中的溶液恰好从无色变为浅紫色,且30s内不变色.
(4)甲同学在滴定开始和结束时,观察到装标准液的滴定管的液面如图所示,则本次滴定所消耗标准液的体积为26.10mL.
(5)乙学生按照滴定步骤进行了3次实验,分别记录有关数据如表:
| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(6)下列操作中可能使测定结果偏低的是CD(填字母).
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(7)草酸是二元弱酸,草酸氢钾在水中电离程度大于水解程度.向10mL0.01mol/L的H2C2O4溶液中滴加0.01mol/LKOH溶液V(mL),当V=a mL时,溶液中满足c(C2O42-)+c(OH-)=c(H+)+c(H2C2O4),则a的数值为10,此时溶液呈酸(填“酸性”或“碱性”或“中性”).
17.常温下,NCl3是一种淡黄色的油状液体.下列对NCl3的有关叙述不正确的是( )
| A. | NCl3分子是由极性键构成的极性分子 | |
| B. | NCl3分子的空间构型为三角锥形 | |
| C. | NCl3中的所有原子均达到8电子稳定结构 | |
| D. | NF3的沸点比NCl3的沸点低是因为N-F比N-Cl键键能小 |

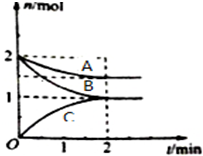 一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示: