题目内容
2.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如图: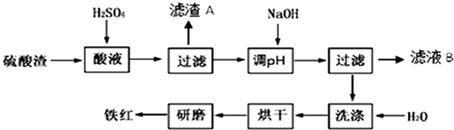
(1)硫酸渣的成分中既能与酸又能与碱反应的是Al2O3,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式:Fe2O3+6H+═2Fe3++3H2O.
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是3.2-3.8(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(4)如何证明洗涤环节充分洗净取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全.
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为$\frac{14b}{15a}$.(用题中所给数据计算并用最简整数比表示结果)
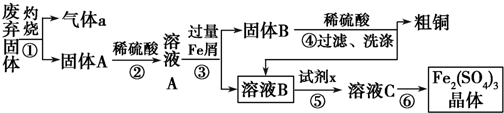
分析 硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,过滤得到滤渣A含有SiO2,滤液含有Fe3+、Al3+、Mg2+,再加氢氧化钠,调节溶液的pH的范围是3.2~3.8可得到Fe(OH)3,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红,滤液B中含有Na2SO4、MgSO4、Al2(SO4)3,以此解答该题.
解答 解:硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,过滤得到滤渣A含有SiO2,滤液含有Fe3+、Al3+、Mg2+,再加氢氧化钠,调节溶液的pH的范围是3.2~3.8可得到Fe(OH)3,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红,滤液B中含有Na2SO4、MgSO4、Al2(SO4)3,
(1)硫酸渣的成分中既能与酸又能与碱反应的是Al2O3,为两性氧化物,Fe2O3与稀硫酸反应的离子反应方程式为Fe2O3+6H+═2Fe3++3H2O,
故答案为:Al2O3;Fe2O3+6H+═2Fe3++3H2O;
(2)由表中数据可知调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,故答案为:3.2-3.8;
(3)由以上分析可知滤渣A的主要成分为SiO2,滤液B含有的主要物质有Na2SO4、MgSO4、Al2(SO4)3,
故答案为:SiO2;Na2SO4、MgSO4、Al2(SO4)3;
(4)固体具有吸附性,氢氧化铁固体表面吸附硫酸根离子,可取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全,
故答案为:取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全;
(5)铁红制备过程中铁元素的质量为(b×$\frac{112}{160}$)÷75%=$\frac{14b}{15}$,则原来硫酸渣中铁元素质量分数为$\frac{14b}{15a}$,故答案为:$\frac{14b}{15a}$.
点评 本题通过制备铁红,考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

请根据如图所示判断下列说法,不正确的是( )
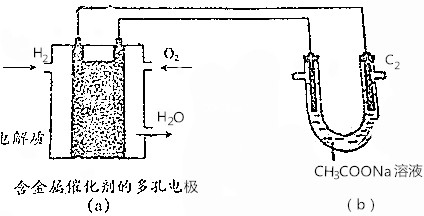
| A. | 若(a)池消耗2.24LH2,则(b)池(C1)极产生0.2mol CO2 | |
| B. | (a)池燃料电池中正极反应式为O2+4e-+4H+═2H2O | |
| C. | 将(b)池电解后的溶液加热蒸干,得到NaOH固体 | |
| D. | (b)池右侧石墨电极(C2)为电解池阴极 |
| A. | 该反应中,生成物的总能量大于反应物的总能量 | |
| B. | 该反应中,断裂化学键会放出能量 | |
| C. | 乙醇的燃烧热为683.4KJ/mol | |
| D. | 反应$\frac{1}{2}$C2H5OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+$\frac{3}{2}$H2O(g)△H>-683.4KJ/mol |
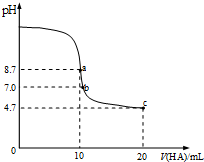
| A. | a点所示溶液中:c(Na+)>c(A-)>c(HA)>c(OH-) | |
| B. | a~b段溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) | |
| C. | pH=7时的溶液中:c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中:c(HA)>c(Na+)>c(A-) |
| A. | 标准状态下,2.24LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9gNa2O2晶体中所含的离子总数 | |
| D. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数 |
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |