题目内容
1.下列叙述中正确的是( )| A. | 电力是一次能源 | B. | 水力是二次能源 | ||
| C. | 煤、石油、天然气是一次能源 | D. | 水煤气是一次能源 |
分析 能源是自然界赋存的已经查明和推定的能够提供热、光、动力和电能等各种形式的能量来源.包括一次能源和二次能源.一次能源又分为可再生能源(水能、风能及生物质能)和非再生能源(煤炭、石油、天然气、油页岩等),其中煤炭、石油和天然气三种能源是一次能源的核心,它们成为全球能源的基础;除此以外,太阳能、风能、地热能、海洋能、生物能以及核能等可再生能源也被包括在一次能源的范围内;二次能源则是指由一次能源直接或间接转换成其他种类和形式的能量资源,例如:电力、煤气、汽油、柴油、焦炭、洁净煤、激光和沼气等能源都属于二次能源.
A.根据能源的分类知识判断,自然界中以现成形式提供的能源称为一级能源,需要依靠他能源的能量间接制取的能源称为二级能源;
B.水能是自然界中以现成形式提供的能源;
C.煤、石油、天然气等化石燃料可以从自然界直接获得;
D.水煤气是碳和水蒸气反应生成一氧化碳和氢气的混合气体,是化石燃料的能源转化形式;
解答 解:A.电力是通过物质燃烧放热转化成的,或是由风能、水能、核能等转化来的,为二次能源,故A错误;
B.水力是自然界中以现成形式提供的能源,不是二次能源,为一次能源,故B错误;
C.煤、石油、天然气等化石燃料可以从自然界直接获得,为一次能源,故C正确;
D.水煤气是一次能源的转化形式,属于二次能源,故D错误;
故选C.
点评 本题主要考查一次能源和二次能源的定义,题目难度不大,学习中注意相关基础知识的积累.理解能源的来源才能正确判断.

练习册系列答案
相关题目
11.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
12.某元素原子的最外层电子数是次外层的电子数的n倍(n为大于1的自然数),则该原子核内的质子数是( )
| A. | 2n | B. | 2n+2 | C. | 2n+10 | D. | n+2 |
9.室温下,水的电离达到平衡:H2O?H++OH-.下列叙述正确的是( )
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |
16.下列离子方程式正确的是( )
| A. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
6.某果园中的绿橙因缺氮生长不良,叶色泛黄,应施用下列化肥中的( )
| A. | KCl | B. | K2CO3 | C. | CO(NH2)2 | D. | Ca(H2PO4)2 |
13.下列解释实验现象的方程式错误的是( )
| A. | 向苯酚溶液中逐滴加入浓溴水,生成白色沉淀: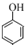 +3Br2→ +3Br2→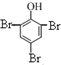 ↓+3HBr ↓+3HBr | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ | |
| C. | 向水杨酸(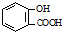 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: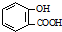 +2HCO3-→ +2HCO3-→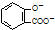 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向Ba(OH)2中加入H2SO4至中性:Ba2++OH-+SO42-+H+→BaSO4↓+H2O |
10.下列关于胶体的叙述正确的是( )
| A. | NaCl分散在无水酒精中,形成的分散系是胶体 | |
| B. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| C. | 胶体带电荷,而溶液呈电中性 | |
| D. | 在胶体中通电时,分散质微粒一定向某一极移动,在溶液中通电时,溶质微粒一定向两极移动 |
11.如表是元素周期表的一部分,针对表中的①〜⑩种元素,问答下列问题
(1)元素①的名称是硼,比元素⑧质子数多10的元素在周期表中所处位置第四周期第ⅤⅢ族
(2)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为NH3+HNO3=NH4NO3
(3)用电子式表示元素⑨与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)表示②与⑦形成的化合物的电子式: ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.
(5)元素⑥的氢化物的结构式为H-S-H;该氢化物常温下和元素⑦的单质反应的化学方程式为H2S+Cl2=S+2HCl
(6)④,⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是S2->Cl->O2-•
(7)某原子有6个电子、7个中子,写出其元素符号:$\stackrel{13}{6}$C.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | VIA | ⅥA | O族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为NH3+HNO3=NH4NO3
(3)用电子式表示元素⑨与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示②与⑦形成的化合物的电子式:
 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.(5)元素⑥的氢化物的结构式为H-S-H;该氢化物常温下和元素⑦的单质反应的化学方程式为H2S+Cl2=S+2HCl
(6)④,⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是S2->Cl->O2-•
(7)某原子有6个电子、7个中子,写出其元素符号:$\stackrel{13}{6}$C.