题目内容
工业上制取碘酸钾的反应为:I2+2KClO3=2KIO3+Cl2↑,下列叙述正确的是( )
| A、氧化性:I2>Cl2 |
| B、每生成1 mol KIO3转移电子2 mol |
| C、该反应是置换反应 |
| D、反应物和生成物中只含有共价键 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:2KClO3+I2=2KIO3+Cl2中,Cl元素的化合价由+5价降低为0,I元素的化合价由0升高为+5,结合氧化还原反应中的基本概念来解答.
解答:
解:2KClO3+I2=2KIO3+Cl2中,Cl元素的化合价由+5价降低为0,I元素的化合价由0升高为+5,
A.元素的非金属性越强,则单质的氧化性越强,非金属性:Cl>I,则氧化性:Cl2>I2,故A错误;
B.由反应可知,每生成1 mol KIO3转移的电子数为2×(5-0)=10mole-,故B错误;
C.一种单质与一种化合物反应生成另一种单质和另一种化合物的反应为置换反应,则该反应是置换反应,故C正确;
D.KClO3和KIO3中含有离子键,故D错误;
故选C.
A.元素的非金属性越强,则单质的氧化性越强,非金属性:Cl>I,则氧化性:Cl2>I2,故A错误;
B.由反应可知,每生成1 mol KIO3转移的电子数为2×(5-0)=10mole-,故B错误;
C.一种单质与一种化合物反应生成另一种单质和另一种化合物的反应为置换反应,则该反应是置换反应,故C正确;
D.KClO3和KIO3中含有离子键,故D错误;
故选C.
点评:本题考查氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,并熟悉氧化还原反应中的概念来解答,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
下列有关离子反应或离子方程式的叙述中,正确的是( )
| A、能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 | ||||
B、惰性电极电解氯化铝溶液:2Cl-+2H2O
| ||||
| C、镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O | ||||
| D、将10 mL 0.1 mol?L-1 KAl(SO4)2溶液和10 mL 0.2 mol?L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2 |
在某物质的量浓度的Na2CO3和NaHCO3的混合溶液中,下列关系一定正确的是( )
| A、C(Na+)+C(H+)=C(CO32-)+C(HCO3-)+C(OH-) |
| B、C(Na+)>C(HCO3-)>C(CO32-)>C(OH-) |
| C、C(Na+)>[C(CO32-)+C(HCO3-)+C(H2CO3)] |
| D、C(CO32-)>C(HCO3-)>C(H+)>C(OH-) |
下列化学用语或模型表示不正确的是( )
A、硝基苯的结构简式: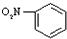 |
| B、葡萄糖的实验式(最简式)为:C6H12O6 |
C、乙酸的分子比例模型图为: |
D、CH3Cl的电子式: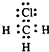 |
2012年2月新华网报道,加拿大开发出生产医用放射性同位素:4399Te简单方法.下列关于4399Te的叙述正确的是( )
| A、原子序数是99 |
| B、电子数是43 |
| C、中子数是99 |
| D、质量数是43 |
已知在一定条件下有CO(g)+H2O(g)?CO2(g)+H2(g),在某一容积为2L的密闭容器中,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=a kJ/mol,反应达平衡后,测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A、反应放出的热量为0.04a KJ |
| B、平衡时H2O的转化率为40% |
| C、若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
| D、判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):