题目内容
已知在一定条件下有CO(g)+H2O(g)?CO2(g)+H2(g),在某一容积为2L的密闭容器中,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=a kJ/mol,反应达平衡后,测得c(CO):c(CO2)=3:2,下列说法正确的是( )
| A、反应放出的热量为0.04a KJ |
| B、平衡时H2O的转化率为40% |
| C、若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
| D、判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
考点:化学平衡的计算
专题:化学平衡专题
分析:设达到平衡时,CO转化xmol,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡(0.2-x)mol (0.2-x)mol xmol xmol
则有(0.2-x):x=3:2
x=0.08mol,
以此解答该题.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡(0.2-x)mol (0.2-x)mol xmol xmol
则有(0.2-x):x=3:2
x=0.08mol,
以此解答该题.
解答:
解:设达到平衡时,CO转化xmol,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡:(0.2-x)mol (0.2-x)mol xmol xmol
则有(0.2-x):x=3:2
x=0.08mol,
A.反应放出的热量为0.08akJ,故A错误;
B.平衡时H2O的转化率为
×100%=40%,故B正确;
C.反应前后气体的体积不变,压强对平衡移动无影响,故C错误;
D.判断平衡的标志是正逆反应速率相同,各成分难度不变,与四种物质浓度相同无关,故D错误;
故选:B.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始:0.2mol 0.2mol 0 0
转化:xmol xmol xmol xmol
平衡:(0.2-x)mol (0.2-x)mol xmol xmol
则有(0.2-x):x=3:2
x=0.08mol,
A.反应放出的热量为0.08akJ,故A错误;
B.平衡时H2O的转化率为
| 0.08mol |
| 0.2mol |
C.反应前后气体的体积不变,压强对平衡移动无影响,故C错误;
D.判断平衡的标志是正逆反应速率相同,各成分难度不变,与四种物质浓度相同无关,故D错误;
故选:B.
点评:本题考查化学平衡的计算,题目难度中等,解答本题的关键是根据浓度关系计算平衡时各物质的物质的量,注意利用三段式法计算较为直观.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
工业上制取碘酸钾的反应为:I2+2KClO3=2KIO3+Cl2↑,下列叙述正确的是( )
| A、氧化性:I2>Cl2 |
| B、每生成1 mol KIO3转移电子2 mol |
| C、该反应是置换反应 |
| D、反应物和生成物中只含有共价键 |
已知t℃时,盐M(不含结晶水,式量为126)的溶解度为Sg.在一定量的M的水溶液中加入agM后,恰好形成t℃时的饱和溶液,则需加入的M?7H2O的质量为( )
| A、2ag | ||
| B、(2+S/100)ag | ||
C、
| ||
D、(1+
|
在“粗盐提纯”的实验中,蒸发时正确的操作是:( )
| A、把浑浊的液体倒入蒸发皿内加热 | ||
| B、开始析出晶体后用玻璃棒搅拌 | ||
C、蒸发时液体不超过蒸发皿容积的
| ||
| D、蒸发皿中出现大量固体时即停止加热 |
将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g).反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中不正确的是( )
| A、容器里气体的密度为40 g/L |
| B、SO3的分解率为20% |
| C、在这10 min内的平均速率为υ(O2)=0.005 mol?L-1?min-1 |
| D、化学反应速率:υ(Ag2SO4)=υ(SO3) |
已知分解1mol H2O2放出热量98kJ.在含少量I-的溶液中,H2O2分解的机理为H2O2+I--→H2O+IO- 慢 H2O2+IO--→H2O+O2+I- 快下列有关该反应的说法正确的是( )
| A、反应速率与I-浓度有关 |
| B、IO-是该反应的催化剂 |
| C、当反应放出98 kJ的热量时会生成1 mol O2 |
| D、v(H2O2)=v(H2O)=v(O2) |

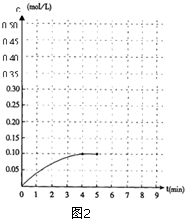 内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2:
内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2: