题目内容
将足量澄清石灰水加入250ml碳酸钠溶液中,过滤、干燥后得到10g沉淀.
(1)求此碳酸钠溶液的物质的量浓度.
(2)若取出这10g沉淀,向其中加入足量的稀盐酸充分反应,求最终产生的气体在标准状况下的体积.
(1)求此碳酸钠溶液的物质的量浓度.
(2)若取出这10g沉淀,向其中加入足量的稀盐酸充分反应,求最终产生的气体在标准状况下的体积.
考点:化学方程式的有关计算
专题:
分析:(1)发生反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,10g沉淀为碳酸钙,根据方程式计算碳酸钠的物质的量,再根据c=
计算;
(2)发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,据此计算生成二氧化碳的体积.
| n |
| V |
(2)发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,据此计算生成二氧化碳的体积.
解答:
解:(1)令碳酸钠的物质的量为x mol,则:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
1mol 100g
xmol 10g
1mol:xmol=100g:10g
解得x=0.1,
故碳酸钠的物质的量浓度=
=0.4mol/L,
答:碳酸钠的物质的量浓度为0.4mol/L;
(2)设标况下生成二氧化碳的体积为V L,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100g 22.4L
10g V L
100g:10g=22.4L:V L
解得V=2.24,
答:标况下生成二氧化碳的体积为2.24L.
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
1mol 100g
xmol 10g
1mol:xmol=100g:10g
解得x=0.1,
故碳酸钠的物质的量浓度=
| 0.1mol |
| 0.25L |
答:碳酸钠的物质的量浓度为0.4mol/L;
(2)设标况下生成二氧化碳的体积为V L,则:
CaCO3+2HCl=CaCl2+CO2↑+H2O
100g 22.4L
10g V L
100g:10g=22.4L:V L
解得V=2.24,
答:标况下生成二氧化碳的体积为2.24L.
点评:本题考查化学方程式的有关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
检验氯化氢气体中是否混有Cl2,可采用的方法是( )
| A、用干燥的蓝色石蕊试纸 |
| B、用干燥有色布条 |
| C、将气体通入AgNO3溶液 |
| D、用湿润的淀粉碘化钾试纸 |
下列有关说法错误的是( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B、反应N2(g)+3H2(g)=2NH3(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 |
| C、Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| D、纯碱溶于热水中去污效果增强,说明纯碱的水解是吸热反应 |
工业上制取碘酸钾的反应为:I2+2KClO3=2KIO3+Cl2↑,下列叙述正确的是( )
| A、氧化性:I2>Cl2 |
| B、每生成1 mol KIO3转移电子2 mol |
| C、该反应是置换反应 |
| D、反应物和生成物中只含有共价键 |
标准状况下,下列物质占体积最大的是( )
| A、180gH2O |
| B、6.02×1023个CO2 |
| C、44.8LHCl |
| D、6gH2 |
有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中其中X、Y、Z、W同周期,M、Z同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A、X、M两种元素形成的化合物只能存在离子键 |
| B、元素Y、Z、W形成的单质中,每1mol它们的单质均含有NA个分子 |
| C、由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| D、元素W和M的某些单质可作为水处理中的消毒剂 |
 硫酸工业用SO2制取SO3的反应为:2SO2(g)+O2(g)
硫酸工业用SO2制取SO3的反应为:2SO2(g)+O2(g)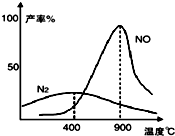 氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):