题目内容
某氯化钠样品中含有少量硫酸钠.某同学对该样品进行提纯的方案如下:

回答下列问题:
(1)操作1的名称是 ;沉淀1是 (填化学式).
(2)得到沉淀2的化学方程式是: .
(3)如何检验滤液1中是否还含有SO42-: .
(4)滤液1中加入过量Na2CO3溶液的目的是 .
(5)你认为该方案是否严密?为什么? .

回答下列问题:
(1)操作1的名称是
(2)得到沉淀2的化学方程式是:
(3)如何检验滤液1中是否还含有SO42-:
(4)滤液1中加入过量Na2CO3溶液的目的是
(5)你认为该方案是否严密?为什么?
考点:物质分离、提纯的实验方案设计,物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:由实验流程可知,加水溶解后与氯化钡反应生成硫酸钡沉淀,则操作1为过滤,沉淀1为硫酸钡;滤液1中含氯化钠、氯化钡,与碳酸钠反应生成碳酸钡,则沉淀2为碳酸钡,滤液2中为NaCl、碳酸钠,应再加盐酸后蒸发结晶得到NaCl,以此来解答.
解答:
解:由实验流程可知,加水溶解后与氯化钡反应生成硫酸钡沉淀,则操作1为过滤,沉淀1为硫酸钡;滤液1中含氯化钠、氯化钡,与碳酸钠反应生成碳酸钡,则沉淀2为碳酸钡,滤液2中为NaCl、碳酸钠,应再加盐酸后蒸发结晶得到NaCl,
(1)由上述分析可知,操作1为过滤,沉淀1为BaSO4,故答案为:过滤;BaSO4;
(2)得到沉淀2的化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)检验滤液1中是否还含有SO42-的方法为取少量滤液1于试管中,加入过量稀盐酸,然后滴入1~2滴BaCl2溶液,观察是否产生白色沉淀,
故答案为:取少量滤液1于试管中,加入过量稀盐酸,然后滴入1~2滴BaCl2溶液,观察是否产生白色沉淀;
(4)滤液1中加入过量Na2CO3溶液的目的是除去溶液中过量的Ba2+,故答案为:除去溶液中过量的Ba2+;
(5)该实验不严密,NaCl中混有碳酸钠,应再加盐酸后蒸发结晶,故答案为:不严密,没有除去过量的Na2CO3.
(1)由上述分析可知,操作1为过滤,沉淀1为BaSO4,故答案为:过滤;BaSO4;
(2)得到沉淀2的化学方程式为Na2SO4+BaCl2=BaSO4↓+2NaCl,故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
(3)检验滤液1中是否还含有SO42-的方法为取少量滤液1于试管中,加入过量稀盐酸,然后滴入1~2滴BaCl2溶液,观察是否产生白色沉淀,
故答案为:取少量滤液1于试管中,加入过量稀盐酸,然后滴入1~2滴BaCl2溶液,观察是否产生白色沉淀;
(4)滤液1中加入过量Na2CO3溶液的目的是除去溶液中过量的Ba2+,故答案为:除去溶液中过量的Ba2+;
(5)该实验不严密,NaCl中混有碳酸钠,应再加盐酸后蒸发结晶,故答案为:不严密,没有除去过量的Na2CO3.
点评:本题考查物质分离提纯实验方案的设计,为高频考点,把握实验流程中的反应及分离方法为解答的关键,注意流程中过量试剂的引入及除去,题目难度不大.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、1L浓度为0.1mol/L AlCl3溶液中含有的离子数是0.4NA |
| B、3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA |
| C、标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA |
| D、标准状况下,1.12L的SO3所含的原子数是0.2NA |
下列离子方程式正确的是( )
| A、钠跟水反应:Na+H2O=Na++OH-+H2↑ |
| B、向AlCl3溶液中加入少量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓ |
| C、碳酸氢钠溶液和少量的澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| D、硫酸溶液与氢氧化钡溶液反应:H++OH-=H2O |

 硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.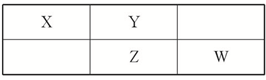 四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
 短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1.
 的系统命名
的系统命名