题目内容
2.现有短周期元素构成的3种单质甲、乙、丙,它们在一定条件下能发生如下变化,部分产物已略去.
(1)若反应①可在常温下进行,则A的电子式为
 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.(2)反应②的化学方程式为4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,该反应是放热(填“放热”或“吸热”)反应.
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化为C.从C溶液中得到晶体的过程被称为结晶,将得到的晶体转化为C的实验条件是在HCl气流中加热.
(4)反应③中氧化剂与还原剂的物质的量之比为1:2.
分析 短周期元素构成的3种单质甲、乙、丙,A和二氧化锰反应生成甲,甲单质和乙点燃反应生成B,若反应①可在常温下进行,A为H2O2,甲为O2,若反应①需在加热条件下进行,则A为KClO3,反应②在高温下进行,该反应为铝热反应,所以乙为Al,B为Al2O3,E的浓溶液能与二氧化锰反应生成丙,则E为浓盐酸,丙为Cl2,C为AlCl3.
解答 解:短周期元素构成的3种单质甲、乙、丙,A和二氧化锰反应生成甲,甲单质和乙点燃反应生成B,若反应①可在常温下进行,A为H2O2,甲为O2,若反应①需在加热条件下进行,则A为KClO3,反应②在高温下进行,该反应为铝热反应,所以乙为Al,B为Al2O3,E的浓溶液能与二氧化锰反应生成丙,则E为浓盐酸,丙为Cl2,C为AlCl3.
(1)若反应①可在常温下进行,A为H2O2,A的电子式为  ,若反应①需在加热条件下进行,则反应①的化学方程式为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
,若反应①需在加热条件下进行,则反应①的化学方程式为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
故答案为: ;2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
;2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;
(2)反应②的化学方程式为4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,该反应是放热反应,
故答案为:4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;放热;
(3)从AlCl3溶液中得到晶体的过程被称为结晶,将得到的晶体转化为C的实验条件是:在HCl气流中加热,防止氯化铝水解,
故答案为:结晶;在HCl气流中加热;
(4)反应③的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,二氧化锰为氧化剂,HCl为还原剂,结合生成氯气可知有$\frac{1}{2}$的HCl起还原剂作用,反应中氧化剂与还原剂的物质的量之比为1:2,
故答案为:1:2.
点评 本题考查无机物推断,注意根据中学常见与二氧化锰有关的反应推断,关键是对铝热反应的掌握,基本属于猜测验证型题目.


下列说法不正确的是( )
| A. | 若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 | |
| B. | 有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 | |
| C. | 有机物C的所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D能发生加成、取代、氧化、还原等反应 |
| A. | NaH、NH3都属于共价化合物 | B. | 12C、C60都属于碳的同素异形体 | ||
| C. | 水玻璃、硅酸都属于胶体 | D. | 生铁、青铜都属于合金 |
| 选项 | 诗句 | 相关物质 | 相关说法 |
| A | 春蚕到死丝方尽 | 纤维素 | 高分子化合物 |
| B | 蜡炬成灰泪始干 | 脂肪烃 | 不饱和烃 |
| C | 沧海月明珠有泪 | 碳酸钙 | 强电解质 |
| D | 蓝田日暖玉生烟 | 二氧化硅 | 两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 取a g混合物用酒精灯充分加热后质量减少b g | |
| B. | 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加b g | |
| C. | 取a g混合物与足量氢氧化钡溶液充分反应,过滤、洗涤、烘干,得b g固体 | |
| D. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸V mL |

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
| A. | 按系统命名法,化合物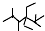 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| C. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| D. | 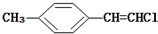 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
| A. | X的结构简式为HCOOCH2CH3 | B. | Y的分子中不含-CH3(甲基) | ||
| C. | Z不具有氧化性 | D. | Z分子中含有甲基且具有还原性 |
| A. | 3,4,4-三甲基己烷 | B. | 3-乙基-1-丁烯 | ||
| C. | 1,2-二甲苯 | D. | 3-甲基-1-丁炔 |