题目内容
14.下列说法正确的是( )| A. | 按系统命名法,化合物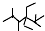 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| C. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| D. | 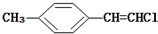 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
分析 A.烷烃命名时遵循“小”的原则,支链编号之和最小;
B.能被催化氧化生成醛的醇中,醇羟基连接的C原子上必须含有2个H原子;
C.乙酸和乙醇的酯化反应是可逆反应;
D.该分子中甲基具有甲烷结构特点.
解答 解:A.烷烃命名时遵循“小”的原则,支链编号之和最小,则烷烃名称是2,2,4,5-四甲基-3,3-二乙基己烷,故A错误;
B.分子式为C5H12O的有机物,它的同分异构体中,经氧化可生成醛,该有机物属于醛,且连接羟基的碳原子上含有2个氢原子,确定C5H12的同分异构体,-OH取代C5H12中甲基上的H原子,
C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、(CH3)4C,
当烷烃为CH3CH2CH2CH2CH3,-OH取代甲基上的H原子有1种结构,
当烷烃为(CH3)2CHCH2CH3,-OH取代甲基上的H原子有2种结构,
当烷烃为(CH3)4C,-OH取代甲基上的H原子有1种结构,
C5H12O的同分异构体中可以氧化为醛的醇有4种,故B正确;
C.乙酸和乙醇的酯化反应是可逆反应,所以反应物不能完全转化为生成物,则不能得到1mol乙酸乙酯,故C错误;
D.该分子中甲基具有甲烷结构特点,甲烷是正四面体结构,所以该分子中所有原子不可能共平面,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,涉及同分异构体判断、原子共面、有机物命名等知识点,侧重考查学生分析判断、知识综合运用及知识迁移能力,明确物质结构特点、基本规则等知识点是解本题关键,易错选项是B.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
5.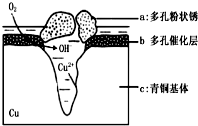 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )
 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2 ( OH )3 Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极 b 被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145gCu 2 ( OH ) 3 Cl,则理论上消耗标准状况氧气体积为 0.448L | |
| D. | 正极的电极反应式为:正极反应是 O2+4e-+2H2O=4OH- |
9. 在一定温度下,将1mol X气体和1mol Y气体充入2L密闭容器中,发生如下反应:X(g)+Y(g)?aZ(g)+W(s)△H>0,t1时刻达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间的变化如下图所示,下列说法正确的是( )
在一定温度下,将1mol X气体和1mol Y气体充入2L密闭容器中,发生如下反应:X(g)+Y(g)?aZ(g)+W(s)△H>0,t1时刻达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间的变化如下图所示,下列说法正确的是( )
 在一定温度下,将1mol X气体和1mol Y气体充入2L密闭容器中,发生如下反应:X(g)+Y(g)?aZ(g)+W(s)△H>0,t1时刻达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间的变化如下图所示,下列说法正确的是( )
在一定温度下,将1mol X气体和1mol Y气体充入2L密闭容器中,发生如下反应:X(g)+Y(g)?aZ(g)+W(s)△H>0,t1时刻达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间的变化如下图所示,下列说法正确的是( )| A. | 该反应在0~t1时间段的速率为:ν(W)=0.25/t1 mol•L-1•min-1 | |
| B. | 反应方程式中的a不可能等于1 | |
| C. | t2时刻改变的条件是通入少量气体Z | |
| D. | t3时刻改变的条件是移去少量物质W |
19.化学在生产、科研和日常生活中有着密切( )
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
6.已知:①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-a kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-b kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-c kJ/mol
④H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-d kJ/mol
下列叙述不正确的是( )
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-b kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-c kJ/mol
④H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-d kJ/mol
下列叙述不正确的是( )
| A. | 由上述热化学方程式可知d>c | |
| B. | H2的燃烧热为d kJ/mol | |
| C. | CH3OH(g)═CO(g)+2H2(g)△H=(b+2c-a)kJ/mol | |
| D. | 当CO和H2的物质的量之比为1:2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为$\frac{Q}{b+2c}$mol |
17.设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子 | |
| B. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| C. | 由14g CO中含有的原子数为NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,转移电子数4 NA |
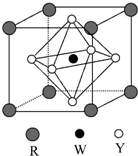 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与氩原子相同;R原子的d轨道上有3个空轨道.请回答下列问题: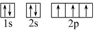 ,R基态原子的价层电子排布式为3d24s2.
,R基态原子的价层电子排布式为3d24s2.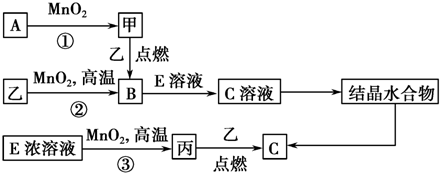
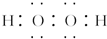 .若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.
.若反应①需在加热条件下进行,则反应①的化学方程式为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑.